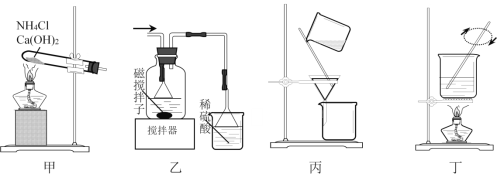
题目内容
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
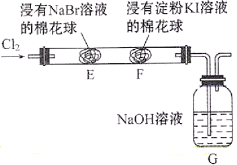
A.E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
【答案】B
【解析】
F处棉花球变成蓝色,说明F处KI被氧化成I2;而Cl2和Br2均能与KI反应生成I2,故不能说明Br2的氧化性比I2强。
A.E处棉花球变成橙黄色,发生Cl2+2Br-=2Cl-+Br2,说明Cl2的氧化性比Br2强,A说法正确;
B.F处棉花球变成蓝色,则可能为Cl2或Br2氧化的I-,无法说明Br2的氧化性比I2强,B说法不正确;
C.E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,C说法正确;
D.G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,D说法正确;
综上所述,答案为B。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】回答下列问题:
I.乳酸(![]() )、酒精、醋酸、淀粉等都是生活中常见的物质。
)、酒精、醋酸、淀粉等都是生活中常见的物质。
(1)在生活中,常选择上述物质中_______________(填结构简式)清洗水壶里的水垢。
(2)生活中常选择_______________酒精![]() 选择“75%”“95%”或“无水”
选择“75%”“95%”或“无水”![]() 皮肤消毒。
皮肤消毒。
(3)上述物质中,属于天然高分子化合物的是_________________![]() 填名称
填名称![]() 。
。
(4)乳酸中发生如下变化:![]() ,则所用的试剂a为________(写化学式)。
,则所用的试剂a为________(写化学式)。
II.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最外层电子数是次外层的2倍 |
Y | M层上的电子数是K层的3倍 |
Z | Z的一种核素的质量数为53,中子数为34 |
W | W2+与氖原子具有相同核外电子排布 |
(5)X在元素周期表中的位置为___________;Y元素的名称为________________。
(6)元素W的离子结构示意图是_______________;Z、Y形成的化合物为____________(用化学式表示)。