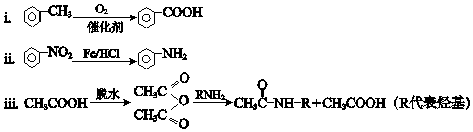题目内容
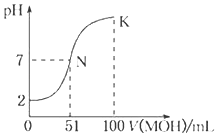
【题目】下列电子层中具有的能量最低的是( )
A.K层B.L层C.M层D.N层
【答案】A
【解析】
离核越近的电子能量越低,据此可知,选项A正确。

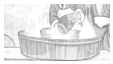
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
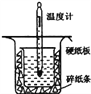
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差
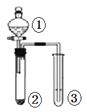
【题目】利用如图所示装置进行下列四组实验,不能得到相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液变浅 | SO2有还原性 | |
B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、强氧化性 |
A. A B. B C. C D. D