题目内容
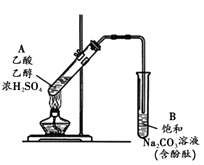
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是___________________。
(2)若改用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应与上述实验相比,所放出的热量_____________(填“相等”“不相等”),若实验操作均正确,则所求中和热______(填“相等”“不相等”)
(3) 写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):_____________________________________。
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________(结果保留一位小数)。
(5)上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________________________。
a.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.实验装置保温、隔热效果差
【答案】 环形玻璃搅拌棒 不相等 相等 HCl(aq)+NaOH(aq)=NaC l(aq)+H2O(l) △H=-57.3kJmol-1 -51.8 acd
【解析】(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;(2)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.25 molL-1H2SO4和50mL 0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;(3) 中和热数值为57.3kJ/mol,故稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为:HCl(aq)+NaOH(aq)=NaC l(aq)+H2O(l) △H=-57.3kJmol-1;(4)第一次测定温度差为:(23.2-20.05)℃=3.15℃,第二次测定的温度差为:(23.4-20.3)℃=3.1℃,第三次测定的温度差为:(23.6-20.55)℃=3.05℃,三次温度差的平均值为: ![]() ℃=3.1℃;50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.1℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.1℃=1295.8J,即1.2958KJ,所以实验测得的中和热△H=-
℃=3.1℃;50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.1℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.1℃=1295.8J,即1.2958KJ,所以实验测得的中和热△H=-![]() =-51.8 kJ/mol;(5)a.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,选项a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,选项b错误;c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,选项c正确;d.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,选项d正确;答案选项acd。
=-51.8 kJ/mol;(5)a.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,选项a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,选项b错误;c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,选项c正确;d.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,选项d正确;答案选项acd。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%