��Ŀ����
����Ŀ�������£���100mL0.01molL��1HA��Һ����μ���0.02molL��1MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯�������Һ����仯���Բ��ƣ�������˵������ȷ���ǣ������� 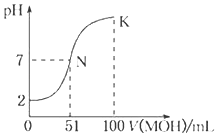
A.MOHΪһԪǿ��HAΪһԪǿ��
B.K ���Ӧ����Һ�У�c��M+��+c��MOH��=c��A����
C.K���Ӧ����Һ�У�c��MOH��+c��OH������c��H+��=0.005molL��1
D.N��ˮ�ĵ���̶�С��K��ˮ�ĵ���̶�
���𰸡�C
���������⣺A.0.01molL��1 HA��Һ��pH=2����HA��ǿ�ᣬN��Ϊ������Һ��51mLMOHǡ����Һ�����ԣ�˵����Ϊ�����A����
B����c��V��֪��K����ҺΪ������MA��MOH���������غ��֪c��M+��+c��MOH��=2c��A��������B����
C����K��ʱ�����Һ����Ǽ���Һ��2�����������غ�����Һ����仯��֪c��MOH��+c��M+��=0.01molL��1�����ݵ���غ��c��M+��+c��H+��=c��OH����+c��A������c��MOH��+c��OH������c��H+��=c��M+����c��A����+c��MOH��=0.01molL��1��0.005molL��1=0.005molL��1����C��ȷ��
D����ͼ���֪��N����Һ�����ԣ�ˮ�����������Ϊ10��7mol/L��K����Һ�ʼ��ԣ�MOH���������������������ˮ���룬ˮ�����������С��10��7mol/L������N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶ȣ���D����
��ѡC��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
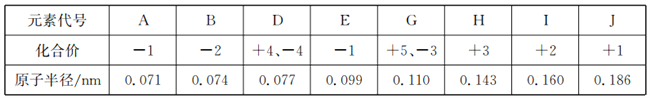
�ٷ�ѧ����ҵ��������ϵ�д�����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±�����֪X�Ƕ�����������õĽ���������Rͬ���ڣ������û�ѧ������⣩
Ԫ�ش��� | X | Y | Z | M | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
��Ҫ���ϼ� | +1 | +6��2 | +5��3 | ��2 | +3 |
��1��R��Ԫ�ط���Ϊ�� M��Ԫ�����ڱ��е�λ��Ϊ ��
��2��X��Y��ԭ�Ӹ�����1��1���ɵ����ʵĵ���ʽΪ��������ѧ������ ��
��3��X+ �� Y2��M2���Ӱ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ�� ��
��4����Cu������������ʯī��������X������������Ӧ��ˮ������Һ�����Һ���е�⣬д�������ĵ缫��Ӧʽ ��
����ͼת����ϵA ![]() B
B ![]() C����BΪ��ɫ��״�������A��C��Ӧ�����ӷ���ʽΪ ��
C����BΪ��ɫ��״�������A��C��Ӧ�����ӷ���ʽΪ ��
����Ŀ��ij�¶��£���Ӧ 2CH3OH��g�� ![]() CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ400�����¶��£����ݻ�һ�����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
Ũ��/��molL��1�� | 0.44 | 0.6 | 0.6 |
����˵����ȷ���ǣ� ��
A.CH3OH����ʼŨ��Ϊ1.04mol/L
B.��ʱ�淴Ӧ���ʴ�������Ӧ����
C.ƽ��ʱCH3OH��Ũ��Ϊ0.04mol/L
D.ƽ��ʱCH3OH��ת����С��80%