题目内容
【题目】关于反应4Al+3TiO2+3C===2Al2O3+3TiC的叙述正确的是:
A. 生成1 mol TiC时转移4 mol电子 B. TiO2是氧化剂,TiC是还原产物
C. 反应中氧化剂与还原剂的物质的量之比是1∶1 D. Al是还原剂,TiC是氧化产物
【答案】A
【解析】根据方程式可知,Al的化合价从0价升高到+3价,失去3个电子,铝是还原剂,氧化铝是氧化产物;碳元素的化合价从0价降低到-4价,得到4个电子,所以碳是氧化剂,TiC是还原产物,故A正确。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL﹣1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL﹣1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是 .
②II中发生了分解反应,反应的化学方程式是 .
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,设计实验(图1)IV进行探究: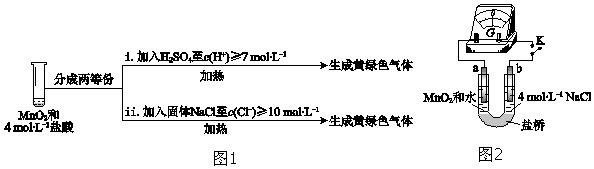
将实验 III、IV作对比,得出的结论是;将 i、ii作对比,得出的结论是 .
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是 .
(2)研究盐酸能否被氧化性酸氧化. ①烧瓶中放入浓H2SO4 , 通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3 , 试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2 .
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验 I、II、III证明混合气体中含有Cl2 , III的操作是 .
由上述实验得出:盐酸能否被氧化与氧化剂的种类、有关.
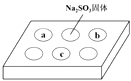
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。( )
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A.浓硫酸与Na2SO3固体发生了氧化还原反应
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+ 2OH—= SO32-+ H2O
D.c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32-) +c(HSO3) + c(OH)
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.