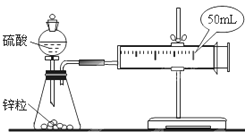
题目内容
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
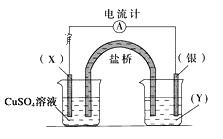
请回答下列问题:
(1)电极X的材料是__,电解质溶液Y是__;
(2)银电极为电池的__极,发生的电极反应为__;
(3)X电极上发生的电极反应为__。
【答案】Cu AgNO3溶液 正 Ag++e- =Ag Cu-2e- =Cu2+
【解析】
根据反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s),在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应式为Cu-2e-=Cu2+,则正极为Ag,Ag+在正极上得电子被还原,电极反应式为Ag++e=Ag,电解质溶液为AgNO3,结合原电池原理分析解答。
(1)由反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液应该为AgNO3,故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应式为Ag++e- =Ag,故答案为:正;Ag++e- =Ag;
(3)Cu被氧化,失电子,应为原电池的负极,电极反应式为Cu-2e- =Cu2+,故答案为:Cu-2e- =Cu2+。

 开心蛙状元测试卷系列答案
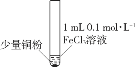
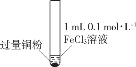
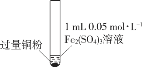
开心蛙状元测试卷系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验 步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验 现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu===2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为____________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是____________(填化学式)。