��Ŀ����
����Ŀ��25��ʱ����0.1mol��L-1HCl��Һ�ζ�20��00mL 0.1mol��L-1BOH��Һ���õĵζ�������ͼ������˵����ȷ����

A. BOHΪһԪ����ζ������ʱ����һԪ����ĵ���ƽ�ⳣ��KbԼΪ10-5.6
B. �μ�����Ĺ����У�����Һ��c(BOH)=c(B+)ʱ�����ܳ�����b��
C. �μ�����Ĺ�����ˮ�ĵ���̶��������ڢڵ�ʱ�ﵽ�������С
D. �����ʾ��Һ�У�c(B+)+c(H+)>c(BOH)+c(OH-)
���𰸡�D
��������A. 0.1mol��L-1BOH��Һ��pHΪ11.2��˵��BOHδ��ȫ���룬ΪһԪ���0.1mol��L-1BOH��Һ��pHΪ11.2����Kb=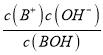 =
=![]() =10-4.6����A����B. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(BOH)��c(B+)����˵���Һ��c(BOH)=c(B+)ʱ�����ܳ�����a�㣬�����ܳ�����b�㣬��B����C. �μ�����Ĺ����У���Һ�ļ�����С����ˮ��������Ƴ̶���С��ˮ�ĵ���̶���������Һ�ﵽ��ʱ�����ɵ���ˮ�⣬�ٽ�ˮ�ĵ��룬ˮ�ĵ���ﵽ���Ȼ������������ˮ�ĵ��룬ˮ�ĵ�������С����C����D. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(Cl-)��c(B+) ��c(BOH)��c(Cl-)�����ݵ���غ�c(B+)+c(H+)= c(Cl-)+c(OH-)>c(BOH)+c(OH-)����D��ȷ����ѡD��
=10-4.6����A����B. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(BOH)��c(B+)����˵���Һ��c(BOH)=c(B+)ʱ�����ܳ�����a�㣬�����ܳ�����b�㣬��B����C. �μ�����Ĺ����У���Һ�ļ�����С����ˮ��������Ƴ̶���С��ˮ�ĵ���̶���������Һ�ﵽ��ʱ�����ɵ���ˮ�⣬�ٽ�ˮ�ĵ��룬ˮ�ĵ���ﵽ���Ȼ������������ˮ�ĵ��룬ˮ�ĵ�������С����C����D. �����ʾ��Һ�У����ڵ�Ũ�ȵ�BCl��BOH����Һ�Լ��ԣ�˵��c(Cl-)��c(B+) ��c(BOH)��c(Cl-)�����ݵ���غ�c(B+)+c(H+)= c(Cl-)+c(OH-)>c(BOH)+c(OH-)����D��ȷ����ѡD��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д� ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�