题目内容
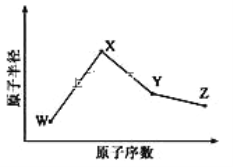
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1; 在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。 请回答下列问题:
(1)X 元素位于元素周期表中位置为_____________。
(2)X 的单质和 Y 的单质相比,熔点较高的是____________(写化学式) 。 Z 所在族的简单氢化物中,沸点最高的是________(写化学式),原因为_________________________。
(3)W、X、Z 三种元素形成的化合物中化学键类型为________;X2W2的电子式为___________________。
(4)Y 与 Z 形 成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,可用于水处理, M 在液态和浓缩气态时具有爆炸性 。 M 的化学式为_____________。 M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,该反应的化学方程式为___________________。
(6)在 25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态, 平均每转移 1mol 电子放热 190kJ, 该反应的热化学方程式为__________________________________。
【答案】.第三周期, 第IA族SiHFHF 分子间能形成氢键离子键、共价键![]() SiCl4 +3H2O=H 2SiO3 +3HClClO26ClO2+6NaOH=NaCl+5NaClO3+3H2OSiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol
SiCl4 +3H2O=H 2SiO3 +3HClClO26ClO2+6NaOH=NaCl+5NaClO3+3H2OSiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol
【解析】
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,原子半径大于O,故X为Na;由原子序数可以知道,Y、Z处于第三周期, Z的吸引电子的能力在同周期主族元素中最大,则Z为Cl,四种元素的最外层电子数之和为18,则Y的最外层电子数为18-6-1-7=4,所以Y为Si。
(1)X 元素为Na元素,位于元素周期表中位置为第三周期,第IA族;
(2)金属Na的熔点较低,Si属于原子晶体,熔点很高,故Si的熔点较高;Cl位于元素周期表第ⅦA族,F的电负性强,分子间可形成氢键,故HF沸点最高;
(3)W、X、Z 三种元素形成的化合物可能为NaClO,离子化合物,其中含有离子键和共价键;X2W2为Na2O2,离子化合物,电子式为:![]() ;
;
(4)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成H2SiO3与HCl,该反应的化学方程式是:SiCl4 +3H2O=H 2SiO3 +3HCl;
(5)Z 的氧化物很多,其中一种黄绿色气体 M,其氧含量为 47.41%,则氯的含量为52.59%设M的化学式为ClxOy,则35.5x:16y=52.59:47.41,计算得x: y=1:2,则M为ClO2;M 可与 NaOH 溶液反应生成两种稳定的盐,它们的物质的量之比为 1︰5,即NaCl 和NaClO3,则反应方程式为:6ClO2+6NaOH=NaCl+5NaClO3+3H2O;
(6)1mol SiH4完全燃烧转移的电子数为8mol,所以放热为190kJ×8=1520kJ,因此热化学方程式为SiH4 (g)+2O2 (g)=SiO2 (s)+2H2O(l) ΔH=—1520kJ/mol。

 53随堂测系列答案
53随堂测系列答案【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B. 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C. 保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D. 保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%