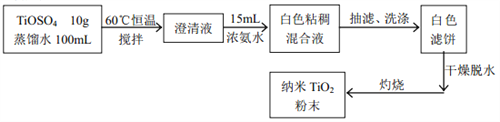
题目内容
【题目】光合作用得地球碳、氧循环的更要媒介。下图是利用模拟光合作用过程,将CO2和H2O转化为糖类同时释放O2的装置。下列说法正确的是
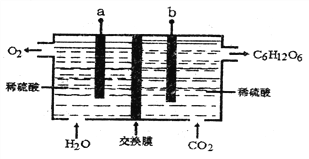
A. 该装置为原电池,其中a是原电池的正极
B. 该交换膜为阳离子交换膜,H+交换膜由左向右移动
C. 不考虑其它能量损耗,当外电路通过1mole-时生成15g葡萄糖
D. b极发生的电极反应:6CO2+24e-+18H2O=C6H12O6+24OH-
【答案】B
【解析】H2O转化成O2,发生了氧化反应,故a电极为负极,b极为正极,负极的电极反应式为2H2O-4e-═O2↑+4H+,正极反应式为6CO2+24H++24e-═C6H12O6+6H2O。A. 根据装置图,二氧化碳和水通过反应后生成了葡萄糖和氧气,有电子的转移,该装置为原电池,二氧化碳被还原,水被氧化,a是原电池的负极,故A错误;B. 该原电池中负极a上水失去电子生成氢离子和氧气,氢离子通过交换膜向正极移动,该交换膜为阳离子交换膜,故B正确;C. 根据正极反应式6CO2+24H++24e-═C6H12O6+6H2O,不考虑其它能量损耗,当外电路通过1mole-时生成葡萄糖的质量为![]() ×180g/mol=7.5g,故C错误;D. 电解质溶液显酸性,b极发生的电极反应为6CO2+24H++24e-═C6H12O6+6H2O,故D错误;故选B。
×180g/mol=7.5g,故C错误;D. 电解质溶液显酸性,b极发生的电极反应为6CO2+24H++24e-═C6H12O6+6H2O,故D错误;故选B。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目