题目内容
13.下列说法正确的是( )| A. | 含金属元素的离子一定是阳离子 | |
| B. | 向新制的CuCl2溶液中滴加NaOH溶液,有红褐色沉淀生成 | |
| C. | 氯水具有漂白性是因为氯水中含有HClO | |
| D. | 如果将过量的二氧化锰与20 mL、12 mol•L-1的盐酸混合加热,充分反应生成氯气的物质的量一定为0.06 mol |
分析 A.含金属元素的离子不一定是阳离子;
B.氢氧化铜为蓝色;
C.氯气和水反应生成HClO,HClO具有强氧化性;
D.稀盐酸与二氧化锰不反应.
解答 解:A.含金属元素的离子不一定是阳离子,例如高锰酸根离子含有金属锰,但是属于阴离子,故A错误;
B.向新制的CuCl2溶液中滴加NaOH溶液,有蓝色沉淀生成,故B错误;
C.氯气和水反应生成HClO,HClO具有强氧化性,能够杀菌消毒,故C正确;
D.如果将过量的二氧化锰与20 mL、12 mol•L-1的盐酸混合加热,随着反应进行盐酸浓度降低,变为稀盐酸与二氧化锰不反应,生成氯气小于0.06 mol,故D错误;
故选:C.
点评 本题考查了物质的性质,主要考查了铜、次氯酸、盐酸的性质,掌握基础是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列材料的特性及用途叙述不正确的是( )
| A. | 氧化铝陶瓷具有两性,可用来制造人造牙齿 | |
| B. | 氮化硅陶瓷耐高温且不易传热,可用来制造柴油机 | |
| C. | 光导纤维传导光的性能很强,是非常好的通讯材料 | |
| D. | 人造刚玉硬度高,用于制造刚玉球磨机 |
1.合理使用药物有利于身心健康.下列有关说法不正确的是( )
| A. | 氢氧化铝用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素 | |
| D. | 非处方药都无毒副作用、可长期大量服用 |
8.人体内最重要的供能物质是( )
| A. | 葡萄糖 | B. | 纤维素 | C. | 油脂 | D. | 蛋白质 |
18.下列反应的离子方程式正确的是( )
| A. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ |
5.某同学在实验室中进行如下实验:
以下结论不正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  | 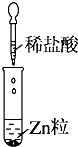 |
| 现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液不反应 | |
| B. | Ⅱ中的白色沉淀为BaSO4 | |
| C. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ | |
| D. | Ⅲ中发生的反应也是氧化还原反应 |
10.25℃时,电离平衡常数:
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是e c d b a(填字母).
(2)常温下,0.1mol/L的CH3COOH溶液的pH═2.85(已知lg2=0.3).
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式CO2+NaClO+H2O=NaHCO3+HClO.
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(用准确的数值表示)
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是e c d b a(填字母).
(2)常温下,0.1mol/L的CH3COOH溶液的pH═2.85(已知lg2=0.3).
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式CO2+NaClO+H2O=NaHCO3+HClO.
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(用准确的数值表示)