题目内容
10.25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是e c d b a(填字母).
(2)常温下,0.1mol/L的CH3COOH溶液的pH═2.85(已知lg2=0.3).
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是BCE
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式CO2+NaClO+H2O=NaHCO3+HClO.
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(用准确的数值表示)
分析 (1)酸的电离平衡常数越小,则酸根离子水解程度越大,相同pH的钠盐溶液浓度越小;
(2)c(H+)=$\sqrt{K•c}$;
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,二者恰好反应生成等物质的量浓度的NaClO和NaHCO3,溶液中存在电荷守恒和物料守恒;
(4)Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3;
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,二者浓度相等,二者恰好反应生成NaHC4H4O6,所得溶液的pH为6,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断.
解答 解:(1)酸的电离平衡常数越小,则酸根离子水解程度越大,相同pH的钠盐溶液浓度越小,根据电离平衡常数知,酸根离子水解程度大小顺序是CO32->ClO->HCO3->CH3COO->C4H4O62-,所以等pH时钠盐浓度大小顺序是e c d b a,故答案为:e c d b a;
(2)c(H+)=$\sqrt{K•c}$=$\sqrt{2.0×1{0}^{-5}×0.1}$mol/L,溶液的PH=-lg$\sqrt{2}$×10-3=3-0.15=2.85,故答案为:2.85;
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,二者恰好反应生成等物质的量浓度的NaClO和NaHCO3,
A.ClO-水解程度>HCO3-,所以存在c(ClO-)<c(HCO3-),故错误;
B.ClO-水解程度>HCO3-,钠离子不水解,溶液呈碱性,所以存在c(Na+)>c(HCO3-)>c(ClO-)>c(H+),故正确;
C.根据物料守恒得c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-),故正确;
D.根据电荷守恒得c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)+c(OH-),故错误;
E.根据质子守恒得c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-),故正确;
故答案为:BCE;
(4)Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),少量二氧化碳和次氯酸钠反应生成NaClO和NaHCO3,反应方程式为CO2+NaClO+H2O=NaHCO3+HClO,
故答案为:CO2+NaClO+H2O=NaHCO3+HClO;
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,二者浓度相等,混合后c(Na+)=0.05mol/L,二者恰好反应生成NaHC4H4O6,所得溶液的pH为6,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(HC4H4O6-)+2c(C4H4O62-)=c(Na+)+c(H+)-c(OH-)=0.05mol/L+10-6mol/L-10-8mol/L=(0.05+10-6-10-8)mol/L,故答案为:(0.05+10-6-10-8)mol/L.
点评 本题考查了离子浓度大小比较,涉及弱电解质电离及盐类水解,知道弱酸电离平衡常数与酸根离子水解程度关系,再结合守恒思想分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 含金属元素的离子一定是阳离子 | |
| B. | 向新制的CuCl2溶液中滴加NaOH溶液,有红褐色沉淀生成 | |
| C. | 氯水具有漂白性是因为氯水中含有HClO | |
| D. | 如果将过量的二氧化锰与20 mL、12 mol•L-1的盐酸混合加热,充分反应生成氯气的物质的量一定为0.06 mol |
 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是Q1<Q3<Q2(用Q1、Q2、Q3表示).
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ.则三者的由小到大关系是Q1<Q3<Q2(用Q1、Q2、Q3表示).(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是减少热量散失; 若实验中不加盖泡沫塑料板,则求得的中和热数值偏小(填偏大、偏小、无影响)
(3)实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用如图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
| A. | 一氧化碳 | B. | 氮气 | C. | 硝酸钠 | D. | 氯化银 |
| A. | 300mL3.5 mol/L KCl溶液 | B. | 1000mL2.5mol/L NaCl溶液 | ||
| C. | 250mL1 mol/L AlCl3溶液 | D. | 200mL2mol/L MgCl2溶液 |
| A. | HX可能是强酸 | B. | HY一定是强酸 | ||
| C. | HX的酸性强于HY的酸性 | D. | 反应开始时二者生成的速率相等 |
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 随着反应的进行,逆反应速率逐渐增大,最后不变 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
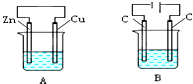 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液: