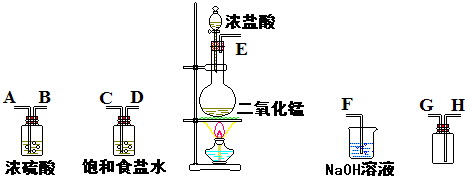
题目内容
3.(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)D.A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氨化铵固体,当固体溶解后,测得溶液pH减水,主要原因是(填序号)C.
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(3)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液,(假设无气体逸出损失).
①NH4+和NH3•H2O两种粒子的物质的量之和等于0.1mol.
②NH4+和H+两种粒子的物质的量之和比OH-多0.05mol.
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,则该溶质是NH4Cl,上述离子浓度大小顺序关系中正确的是(选填序号)A.
②若上述关系中C的是正确的,则溶液中溶质的化学式是NH4Cl和HCl.
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)<c(NH3H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与e(Cl-)的关系c(NH4+)=c(Cl-).
分析 (1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的$\frac{1}{100}$;
(2)氨水是弱电解质存在电离平衡,向溶液中加入相同的离子能抑制氨水电离;
(3)根据物料守恒和电荷守恒来分析;
(4)①任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
②C中离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
③溶液呈中性,则溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒确定溶液中铵根离子浓度和氯离子浓度的关系,氯化铵溶液呈酸性,要使溶液呈中性,氨水应该稍微过量.
解答 解:(1)将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的$\frac{1}{100}$,所以溶液的pH应该9-11之间,
故答案为:D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大平衡向左移动,从而抑制氨水电离,使c(OH-)减小,
故答案为:C;
(3)①根据物料守恒知,c(NH4+)+c(NH3•H2O)=0.1mol,
故答案为:NH4+;NH3•H2O;
②根据溶液中电荷守恒得:c(Cl-)+c(OH-)=c(H+)+c(NH4+)+c(Na+),则c(H+)+c(NH4+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol=0.05mol,
故答案为:NH4+;H+;
(4)①因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合,
故答案为:NH4Cl;A;
②C中离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为:HCl、NH4Cl,
故答案为:NH4Cl和HCl;
③氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则盐酸的物质的量浓度小于氨水,溶液呈中性,溶液中氢离子浓度等于氢氧根离子浓度,溶液呈电中性,所以溶液中氯离子浓度等于铵根离子浓度,
故答案为:<;=
点评 本题考查了弱电解质的电离、离子浓度大小的比较等知识点,题目难度中等,根据物质的性质及物料守恒和电荷守恒来分析解答,试题培养了学生的分析、理解能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 100 mL | B. | 150 mL | C. | 450 mL | D. | 无法计算 |
| A. | 邻二甲苯只有一种 | B. | 对二甲苯只有一种 | ||
| C. | 苯可以燃烧 | D. | 苯能和液溴反应 |
| A. | 锌是正极,铜上有气泡产生 | |
| B. | 电流方向是从锌到铜 | |
| C. | 电解液的pH保持不变 | |
| D. | 当导线中有1mol电子通过时,铜片上析出1 g H2 |
| A. | 金刚石和石墨 | B. | ${\;}_{8}^{16}$O与${\;}_{8}^{18}$O | ||
| C. | CH3COOH与HCOOCH3 | D. | C2H6与C3H8 |
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 漂白粉的有效成分为CaCl2和Ca(ClO)2 | |
| C. | 实验室制备Cl2,可用向上排空气法或排饱和食盐水法收集 | |
| D. | 新制氯水只含有氯气和次氯酸分子 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 含金属元素的离子一定是阳离子 | |
| B. | 向新制的CuCl2溶液中滴加NaOH溶液,有红褐色沉淀生成 | |
| C. | 氯水具有漂白性是因为氯水中含有HClO | |
| D. | 如果将过量的二氧化锰与20 mL、12 mol•L-1的盐酸混合加热,充分反应生成氯气的物质的量一定为0.06 mol |