题目内容
10.在铜-锌-硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是( )①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2 ④铜片上析出1mol H2.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
分析 锌-铜-稀硫酸组成的原电池装置中,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:该原电池放电时,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以电池反应式为
Zn+H2SO4=ZnSO4+H2 ↑.
设当导线中有1mol电子通过时,理论上负极锌片溶解x,铜片上析出氢气y.
Zn+H2SO4=ZnSO4+H2 ↑ 转移电子
65g 2g 2mol
x y 1mol
x=32.5g
y=1g
故选A.
点评 本题以原电池原理为载体考查了物质的量的有关计算,难度不大,根据电池反应式计算即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.关于如图所示装置的叙述,正确的是( )
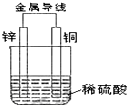

| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量不断减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
18.除去如表物质中所含少量杂质(括号内为杂质),所试剂和分离方法能达到目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙 酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| C | 乙醇(乙酸) | 无 | 分液 |
| D | 甲烷(乙烯) | 溴水 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
5. 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )| A. | 它的化学式为C20H25O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
15.下列说法正确的是( )
| A. | 含有共价键的化合物不一定是共价化合物 | |
| B. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
20.下列化合物的沸点比较,前者低于后者的是( )
| A. | 乙醇和甲醇 | B. | 邻羟基苯甲醛与对羟基苯甲醛 | ||
| C. | 对羟基苯甲酸与邻羟基苯甲酸 | D. | H2O和H2S |
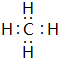 ,其空间构型为正四面体.
,其空间构型为正四面体. .
.


