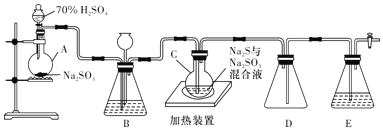
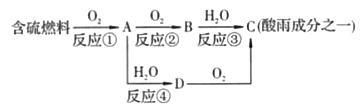
题目内容
【题目】用电解法可提纯含有某些含氧酸根杂质的粗氢氧化钾溶液,其工作原理如图所示。下列说法错误的是

A. 电解过程中,阴极区溶液的pH增大
B. 电解过程中,K+通过阳离子交换膜从阴极区移向阳极区
C. 电解过程中,阳极可发生反应:4OH--4e-==2H2O+O2↑
D. 纯氢氧化钾溶液从b出口导出
【答案】B
【解析】阴极的电极反应是![]() ,有氢氧根离子生成,阴极区溶液的pH增大,故A正确;电解过程中,阳离子移向阴极,K+通过阳离子交换膜从阳极区移向阴极区,故B错误;电解过程中,阳极氢氧根离子放电, 4OH--4e-==2H2O+O2↑,故C正确;阴极的电极反应是
,有氢氧根离子生成,阴极区溶液的pH增大,故A正确;电解过程中,阳离子移向阴极,K+通过阳离子交换膜从阳极区移向阴极区,故B错误;电解过程中,阳极氢氧根离子放电, 4OH--4e-==2H2O+O2↑,故C正确;阴极的电极反应是![]() ,阴极放出氢气,同时生成氢氧化钾,纯氢氧化钾溶液从b出口导出,故D正确。
,阴极放出氢气,同时生成氢氧化钾,纯氢氧化钾溶液从b出口导出,故D正确。

练习册系列答案
相关题目