题目内容
14.下列实验操作与现象对应的实验结论不正确的是( )| 选项 | 实验操作及其现象 | 实验结论 |
| A | 取某卤代烃少许与NaOH的乙醇溶液共热,然后将产生的气体通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色 | 卤代烃与NaOH的乙醇溶液共热生产了烯烃 |
| B | 向铝制易拉罐中充满CO2,然后向罐内注入足量的浓NaOH,立即用胶布封住罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来 | NaOH溶液即可吸收CO2,又可与金属铝反应产生气体 |
| C | 取2mL 0.1mol•L-1 AgNO3溶液,滴入1mL 0.1mol•L-1 KSCN溶液,静置后,向上层清液中滴入FeCl3溶液,溶液变红 | 溶液中仍然有SCN- |
| D | 将在空气中灼烧过的呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变为红色,反复数次,试管中的液体有刺激性气味 | 在此反应中铜丝作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.卤代烃少许与NaOH的乙醇溶液共热,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
B.注入足量的浓NaOH,与二氧化碳反应生成碳酸钠,后Al与NaOH溶液反应生成氢气;
C.存在Ag++SCN-?AgSCN↓平衡;
D.Cu与氧气反应生成CuO,CuO与乙醇反应生成乙醛.
解答 解:A.卤代烃少许与NaOH的乙醇溶液共热,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,应除去乙醇后,再通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色检验乙烯,故A错误;
B.注入足量的浓NaOH,与二氧化碳反应生成碳酸钠,后Al与NaOH溶液反应生成氢气,则罐壁立即内陷,一段时间后,罐壁又重新鼓起来,现象与结论均合理,故B正确;
C.存在Ag++SCN-?AgSCN↓平衡,则向上层清液中滴入FeCl3溶液,溶液变红,可知溶液中仍然有SCN-,故C正确;
D.Cu与氧气反应生成CuO,CuO与乙醇反应生成乙醛,则在此反应中铜丝作催化剂,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、平衡移动、氧化还原反应等,把握反应原理及物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
5.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,下列判断正确的是( )
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
9.枸杞椽酸乙胺嗪可用于驱除肠道虫病,其结构简式如图,下列物质中不能与枸杞椽酸乙胺嗪反应的是( )

| A. | 乙酸 | B. | 乙醇 | C. | 碳酸钠溶液 | D. | 溴水 |
6.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
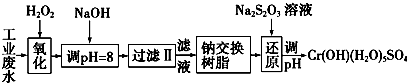
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
3.在一定条件下,对于密闭容器中进行的反应:2SO2(g)+O2(g)?2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是( )
| A. | 正、逆反应速率都等于零 | B. | SO2、O2、SO3的浓度相等 | ||
| C. | SO2、O2、SO3在容器中共存 | D. | SO2、O2、SO3的浓度均不再变化 |

 CH3COOCH2CH2OOCCH3+2H2O.
CH3COOCH2CH2OOCCH3+2H2O.
 、
、 ;.
;.
 ;
;