题目内容
4.A~I是常见有机物,它们之间的转化关系如图所示.其中A是一种烃,E的分子式为C4H8O2,H为有香味的油状物质.
已知:CH3CH2Br+NaOH$\stackrel{水}{→}$CH3CH2OH+NaBr
(1)0.2mol A完全燃烧生成17.6g CO2,7.2g H2O,则A的结构简式为CH2=CH2.
(2)D、G分子中含有官能团的名称分别为羧基、羟基.
(3)①、②、⑥的反应类型分别为加成反应、氧化反应、取代反应.
(4)有机物G可能具有的性质为acde.
a.与金属钠反应 b.与NaOH溶液反应 c.易溶于水
d.使酸性高锰酸钾溶液褪色 e.1mol G完全燃烧消耗2.5mol O2
(5)请写出②、⑤、⑦的化学方程式
反应②2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;
反应⑤CH2=CH2+Br2→CH2BrCH2Br;
反应⑦CH2OHCH2OH+2CH3COOH
 CH3COOCH2CH2OOCCH3+2H2O.
CH3COOCH2CH2OOCCH3+2H2O.(6)实验室用图装置通过反应④制备有机物E

a.向试管a中加入碎瓷片的目的是防止暴沸.
b.试管b中所装试剂为饱和碳酸钠溶液,其作用是降低乙酸乙酯溶解度,吸收乙醇,除去乙酸.反应一段时间后,试管b中的现象是液面上有无色油状液体生成.
c.分离试管b中的混合物得到E,所用到的主要仪器是分液漏斗.
(7)J是有机物I的同系物,且比I多3个碳原子.请写出J可能的结构简式CH3CH2CH2CH2CH3、
 、
、 ;.
;.
分析 根据17.6g CO2的物质的量为:n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,A是一种烃,根据元素守恒可知0.2mol A中n(C)=0.4mol,n(H)=0.4mol×2=0.8mol,则1molA中n(C)=2mol,n(H)=4mol,A为CH2=CH2,A→B:CH2=CH2与水加成反应生成CH3CH2OH,B→C:乙醇在Cu或Ag作催化剂条件下发生氧化反应生成乙醛,
C→D:CH3CHO和氧气反应生成乙酸,A→D:CH2=CH2与氧气反应生成乙酸,反应为:CH2=CH2+O2$→_{加热加压}^{催化剂}$CH3COOH,B+D→E:CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应,A→F:CH2=CH2与溴单质发生加成反应生成1,2-二溴乙烷,F→G:1,2-二溴乙烷发生水解生成乙二醇,G+D→H:乙二醇和乙酸反应生成乙酸乙二酯,据此答题.
(1)根据元素守恒A为CH2=CH2;
(2)根据D、G的结构简式解答;
(3)根据①为加成反应;②为氧化反应;③为氧化反应;④为取代反应;⑤为加成反应;⑥为取代反应;⑦为取代反应分析;
(4)有机物G为CH2OHCH2OH,根据醇羟基的性质分析;
(5)B→C:乙醇在Cu或Ag作催化剂条件下发生氧化反应生成乙醛,A→F:CH2=CH2与溴单质发生加成反应生成1,2-二溴乙烷,G+D→H:乙二醇和乙酸反应生成乙酸乙二酯;
(6)加入碎瓷片或沸石,可防止液体飞溅;制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯;乙酸乙酯密度比水小,不溶于饱和碳酸钠溶液,分离互不相溶的液体,可以分液方法分离;
(7)I为乙烷,J是有机物I的同系物,且比I多3个碳原子为戊烷,戊烷由三种同分异构体;
解答 解:根据17.6g CO2的物质的量为:n(CO2)=$\frac{17.6g}{44g/mol}$=0.4mol,水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,A是一种烃,根据元素守恒可知0.2mol A中n(C)=0.4mol,n(H)=0.4mol×2=0.8mol,则1molA中n(C)=2mol,n(H)=4mol,A为CH2=CH2,
A→B:CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应为CH2=CH2+H2O$→_{加热加压}^{催化剂}$CH3CH2OH,
A→I:CH2=CH2与氢气在一定条件下发生加成反应生成C2H6,反应为CH2=CH2+H2$→_{加热加压}^{催化剂}$CH3CH3,
B→C:乙醇在Cu或Ag作催化剂条件下发生氧化反应,反应为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
C→D:CH3CHO和氧气反应,醛基被氧化为CH3COOH,反应为:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH,
B+D→E:CH3CH2OH和CH3COOH在浓硫酸作用下反应:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,生成E为CH3COOCH2CH3,
CH3COOCH2CH3+H2O,生成E为CH3COOCH2CH3,
A→F:CH2=CH2与溴单质发生加成反应:CH2=CH2+Br2→CH2BrCH2Br,生成1,2-二溴乙烷,
F→G:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$CH2OHCH2OH+2NaBr,生成乙二醇,
G+D→H:CH2OHCH2OH+2CH3COOH CH3COOCH2CH2OOCCH3+2H2O,
CH3COOCH2CH2OOCCH3+2H2O,
(1)根据以上分析可知A为乙烯,A的结构简式为CH2=CH2,
故答案为:CH2=CH2;
(2)D为乙酸含有羧基,G为乙二醇,含有羟基,
故答案为:羧基、羟基;
(3)反应①A→B:CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应为CH2=CH2+H2O$→_{加热加压}^{催化剂}$CH3CH2OH,
反应②B→C:乙醇在Cu或Ag作催化剂条件下发生氧化反应,反应为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
反应⑥F→G:1,2-二溴乙烷在碱性条件下发生水解反应,水解反应属于取代反应,反应为:CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$CH2OHCH2OH+2NaBr,生成乙二醇,
故答案为:加成反应、氧化反应、取代反应;
(4)a.与金属钠反应CH2OHCH2OH+2Na→CH2ONaCH2ONa+H2↑,故a正确;
b.醇不能与NaOH溶液反应,故b错误;
c.乙二醇易溶于水,故C正确;
d.乙二醇醇羟基能被酸性高锰酸钾溶液氧化褪色,故d正确;
e.G为CH2OHCH2OH,2CH2OHCH2OH+5O2$\stackrel{点燃}{→}$4CO2+6H2O,1mol G完全燃烧消耗2.5molO2,故e正确;
故答案为:acde;
(5)反应②:乙醇在Cu或Ag作催化剂条件下发生氧化反应,反应为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
反应⑤:CH2=CH2与溴单质发生加成反应:CH2=CH2+Br2→CH2BrCH2Br,
反应⑦:CH2OHCH2OH+2CH3COOH CH3COOCH2CH2OOCCH3+2H2O,
CH3COOCH2CH2OOCCH3+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;CH2=CH2+Br2→CH2BrCH2Br;CH2OHCH2OH+2CH3COOH CH3COOCH2CH2OOCCH3+2H2O;
CH3COOCH2CH2OOCCH3+2H2O;
(6)乙醇乙酸的混合液体加热容易暴沸,为防止液体飞溅,应加入碎瓷片或沸石,制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,降低乙酸乙酯溶解度,易于分层,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,乙酸乙酯密度比水小,在溶液的上层,不溶于饱和碳酸钠溶液,可观察到b试管中液面上有无色油状液体生成,用分液的方法分离,用分液漏斗分离混合物,
故答案为:防止暴沸;降低乙酸乙酯溶解度,吸收乙醇,除去乙酸;饱和碳酸钠溶液;液面上有无色油状液体生成;分液漏斗;
(7)I为乙烷,J是有机物I的同系物,且比I多3个碳原子为戊烷,戊烷的三种同分异构体分别为CH3CH2CH2CH2CH3,拿下1个碳原子作为支链为 ,拿下2个碳原子作为支链为
,拿下2个碳原子作为支链为 ,
,
故答案为:CH3CH2CH2CH2CH3、 、
、 .
.
点评 本题考查有机物推断,为高频考点,把握官能团与性质的关系、掌握烯烃、卤代烃、醇、醛、羧酸之间的转化关系是解答的关键,题目难度中等.

 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
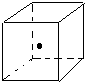
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
| A. | 容器内n(A2):n(B2):n(AB)=1:1:2 | |
| B. | 单位时间内生成2nmolAB,同时生成nmolA2 | |
| C. | 生成B的速率与生成A的速率相等 | |
| D. | 容器内气体的密度不随时间变化 |
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
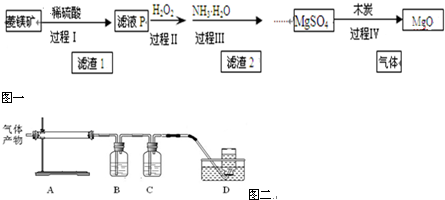
(1)滤液P中含有的阳离子有H+、Fe2+、Mg2+.
(2)过程Ⅱ中发生的氧化还原反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知:
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
(4)过程Ⅳ在800℃煅烧MgSO4,发生多个反应,产物除MgO外,还有SO2、CO2、CO、S等气体产物,利用右图装置判断煅烧产生的气体.
①A中试管壁附着有淡黄色固体,该固体的化学式是S.
②B中盛放的溶液是(填字母)d.
a.NaOH 溶液 b.Na2CO3 溶液
c.稀硝酸 d.KMnO4溶液
③写出800℃煅烧MgSO4,产生气体产物是S 和CO的化学方程式MgSO4+3C$\frac{\underline{\;800℃\;}}{\;}$MgO+S↑+3CO↑.
| 选项 | 实验操作及其现象 | 实验结论 |
| A | 取某卤代烃少许与NaOH的乙醇溶液共热,然后将产生的气体通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色 | 卤代烃与NaOH的乙醇溶液共热生产了烯烃 |
| B | 向铝制易拉罐中充满CO2,然后向罐内注入足量的浓NaOH,立即用胶布封住罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来 | NaOH溶液即可吸收CO2,又可与金属铝反应产生气体 |
| C | 取2mL 0.1mol•L-1 AgNO3溶液,滴入1mL 0.1mol•L-1 KSCN溶液,静置后,向上层清液中滴入FeCl3溶液,溶液变红 | 溶液中仍然有SCN- |
| D | 将在空气中灼烧过的呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变为红色,反复数次,试管中的液体有刺激性气味 | 在此反应中铜丝作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
 A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.
A是一种常见的半导体材料,E是一种白色沉淀.存在下列物质转化关系,据此填写下列空白.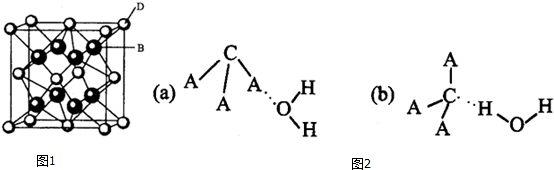
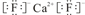 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式). 酚
酚 酮
酮 酯
酯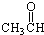 醛
醛 酸.
酸.