题目内容
19.已知下列热化学方程式:①CaCO3(s)═CaO(s)+CO2(g)△H=177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=-131.3kJ/mol
③$\frac{1}{2}$H2SO4(l)+NaOH(l)═$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有①②③.
(2)根据上述信息,写出C转化为CO的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol.
(3)已知0.5mol甲烷与0.5mol水蒸气在t℃.p kPa时,完全反应生成一氧化碳和氢气,吸收了a kJ热量,该反应的热化学方程式是:CH4(g)+H2O(g)═CO(g)+3H2(g),△H=+2akJ/mol.
分析 (1)根据热化学方程式的书写方法,需要注意△H为“-”表示放热反应,△H为“+”表示吸热反应.△H的单位一般为kJ•mol-1(kJ/mol);需要标注物质的聚集状态等;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
解答 解:(1)①CaCO3═CaO(s)+CO2(g)△H=177.7kJ,反应焓变单位为kJ/mol,故错误;
②C(s)+H2O(s)═CO(g)+H2(g)△H=-131.3kJ/mol,水不是固体,故错误;
③$\frac{1}{2}$H2SO4(l)+NaOH(l)═$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3kJ/mol,除水的状态其余状态为“aq”,故错误;
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,符合热化学方程式的书写方法,故正确;
⑤CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol,符合热化学方程式的书写方法,故正确;
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol,符合热化学方程式的书写方法,故正确;
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ/mol,符合热化学方程式的书写方法,故正确;
故答案为:①②③;
(2)④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol
依据盖斯定律④-⑤得到C转化为CO的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(3)甲烷和水蒸气之间的反应方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g),0.5mol甲烷与0.5mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,所以1mol甲烷与1mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了2a kJ热量,
热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g),△H=+2akJ/mol;
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g),△H=+2akJ/mol.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,燃烧热、中和热概念理解应用,题目难度不大.

①将胆矾加热变为白色粉末 ②浓硫酸稀释 ③高锰酸钾分解制氧气 ④生石灰跟水反应生成熟石灰.
| A. | ①④ | B. | ①②③④ | C. | ①③ | D. | ②④ |
| A. | 常温常压下,4.4gCO2物质的量为0.1 mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1 NA个H2O分子含有氢分子数为1 mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
| A. | 电解法 | B. | 热氧化法 | C. | 热还原法 | D. | 热分解法 |
| A. | 太快而且太深的呼吸可导致碱中毒 | |
| B. | 太快而且太深的呼吸可导致酸中毒 | |
| C. | 太浅的呼吸可导致碱中毒 | |
| D. | 太浅的呼吸不会导致酸中毒或碱中毒 |
| A. | 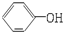 与 与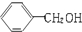 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 分子式为C4H8的烃可能为饱和烃 |
| A. | Na+、Al3+、Cl-、AlO2- | B. | Ba2+、NH4+、Cl-、OH-、 | ||
| C. | H3O+、Cu2+、SO42-、Cl- | D. | Na+、Al3+、Cl-、H+ |
| A. | 硫酸的摩尔质量是98 g | |
| B. | 摩尔是物质质量的单位 | |
| C. | 氮原子的质量就是氮的相对原子质量 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |

| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 用0.0100mol/L硝酸银标准溶液,滴定Cl-、Br-及I-且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |