题目内容
9.下列图示与对应的叙述相符的是( )
| A. | 图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 | |
| B. | 图2中纯水仅升高温度,就可以从a点变到c点 | |
| C. | 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 | |
| D. | 用0.0100mol/L硝酸银标准溶液,滴定Cl-、Br-及I-且浓度均为0.1000mol/L的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
分析 A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,溶液的导电性与溶液中离子浓度成正比;
B、仅升温促进水的电离,氢离子浓度和氢氧根离子浓度增大,氢离子浓度和氢氧根离子浓度相同;
C、b点Kw=10-12,中性溶液pH=6;
D、根据-lgc(x-)越大,c(x-)越小,先形成沉淀的c(x-)越小.
解答 解:A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,即II为醋酸,溶液的导电性与溶液中离子浓度成正比,a点导电能力大于b,故A错误;
B、仅升温促进水的电离,氢离子浓度和氢氧根离子浓度均增大,且氢离子浓度和氢氧根离子浓度相同,与图象不相符合,故B错误;
C、b点Kw=10-12,中性溶液PH=6;将pH=2的硫酸与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故C正确;
D、由图可知,c(I-)最小,先形成沉淀的是I-,故D错误;
故选C.
点评 本题涉及知识点较多,这些知识点都是学习的难点,也是考试热点,根据弱电解质溶液中的电离平衡、盐的水解等知识来分析解答,题目难度中等.

练习册系列答案
相关题目
17.已知H2(g)+Br2(g)═2HBr(g)△H=-70KJ/mol,其它相关数据如下表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol 分子中的化学键断裂时需要吸收的能量/KJ | 410 | a | 370 |
| A. | 400 | B. | 260 | C. | 230 | D. | 200 |
7.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$\stackrel{放电充电}{?}$Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A. | 放电时电解质溶液中的OH-向正极移动 | |
| B. | 充电过程是化学能转化为电能的过程 | |
| C. | 放电时电子从正极经过外线路流向负极 | |
| D. | 充电时Ni(OH)2在阴极失电子 |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:

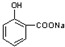 ;
; ;
; .
.