题目内容
9.氧气是一种清洁能源,氧气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJ•mol-1
2H2S(g)═2H2(g)+S2(g)△H=169.8kJ•mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与 H2O(g)反应生成CO2 (g)和 H2(g)的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1.
分析 利用盖斯定律①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)解答,从待求反应出发分析反应物、生成物在所给反应中的位置,通过相互加减可得.
解答 解:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kmol-1.
点评 有关盖斯定律的习题,首先要根据所求的反应分析,分析以下几点:
1、所求反应中的反应物在哪个反应了?是反应物还是生成物?
2、所给反应中哪些物质是所求反应中没有的?
3、如何才能去掉无用的?然后,通过相互加减,去掉无关物质.
将所对应的△H代入上述化学方程式的加减中就可以了.

练习册系列答案
相关题目
17.下列说法不正确的是( )
| A. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| B. | 硅是半导体材料,可用于制备光导纤维 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
4.下列有关说法正确的是( )
| A. | 蔗糖、淀粉、蛋白质、油脂都是营养物质,都属于高分子化合物,都能发生水解反应 | |
| B. | 人造纤维、合成纤维、碳纤维、光导纤维主要成分都是纤维素 | |
| C. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
14.下列实验装置与叙述正确的是( )
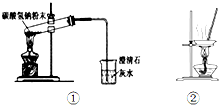

| A. | 用图①所示装置做碳酸氢钠固体受热分解实验 | |
| B. | 用装置②蒸干氯化镁溶液制MgCl2•6H2O | |
| C. | 锥形瓶可用作加热的反应器,滴定时不得用待测溶液润洗 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏低 |
1.相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比为( )
| A. | 3:2 | B. | 2:3 | C. | 1:3 | D. | 1:1 |
19.江苏省已开始大力实施“清水蓝天”工程.下列不利于“清水蓝天”工程实施的是( )
| A. | 将废旧电池深埋,防止污染环境 | |
| B. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |