题目内容
5.已知:①N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H<0,②2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是适当温度、高压、催化剂.实际生产中采取的措施,合成氨是20Mpa~50Mpa、500℃的高温、铁触媒作催化剂,合成SO3是常压、400℃~500℃的高温、V2O5作催化剂.
(2)在合成氨的工业生产中,要分离出氨,目的是减少生成物浓度,平衡正向进行,提高原料的转化率;而合成SO3的过程中,则不需要分离出SO3,原因是二氧化硫的转化率已经很高,分离分离出SO3对二氧化硫的转化率基本无影响.
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应②在一定条件下达到平衡,测得c(SO3)=0.040mol•L-1.计算该条件下反应②的平衡常数K=1.6×103.
分析 (1)实际生产中合成氨采取的措施是20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;
实际生产中合成SO3采取的措施是常压、400℃~500℃的高温、V2O5作催化剂;
(2)将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,提高原料的转化率;
合成SO3的过程中,由于二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响;
(3)依据化学平衡三段式求出各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算.
解答 解:(1)实际生产中合成氨采取的措施是20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;
实际生产中合成SO3采取的措施是常压、400℃~500℃的高温、V2O5作催化剂;
故答案为:20Mpa~50Mpa、500℃的高温、铁触媒作催化剂;常压、400℃~500℃的高温、V2O5作催化剂;
(2)将生成的氨液化并及时从体系中分离出来,减少生成物浓度,平衡正向进行,提高原料的转化率;
合成SO3的过程中,由于二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响,故合成SO3的过程中,则不需要分离出SO3,
故答案为:减少生成物浓度,平衡正向进行,提高原料的转化率;二氧化硫的转化率已经很高,分离出SO3对二氧化硫的转化率基本无影响;
(3)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol•L-1,则
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103;
故答案为:1.6×103.
点评 本题考查工业合成氨和合成SO3的相关知识,以及平衡常数的相关计算,难度中等.要注意基础知识的积累与比较.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | NaHCO3溶液 | B. | KNO3溶液 | C. | 稀醋酸 | D. | Na2SO4溶液 |
| A. | 绿色食品 | B. | 白色污染 | C. | 棕色烟气 | D. | 赤潮 |
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
| A. | 可与钠反应 | |
| B. | 其同类同分异构体共4种 | |
| C. | 其同类同分异构体共6种(包括其本身) | |
| D. | 完全燃烧时耗氧的质量比本身的质量小 |
 (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)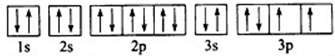 .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.