题目内容
6.由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,其中,A是地壳中含量最多的金属元素,请回答: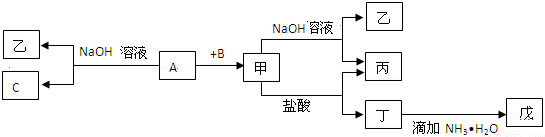
(1)写出下列物质的化学式:甲Al2O3、乙NaAlO2、丁AlCl3戊Al(OH)3.
(2)写出A在元素周期表中的位置:第三周期,第ⅢA族.
(3)写出甲→乙+丙反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O;
A→乙+C反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 A是地壳中含量最多的金属元素,则A为Al,Al与NaOH溶液反应生成C单质及乙,则C为H2,乙为NaAlO2.Al与单质B化合生成甲,能与氢氧化钠溶液、盐酸反应,则甲为Al2O3,B为O2,结合转化关系可知,丙为H2O,丁为AlCl3,丁与氨水反应生成戊为Al(OH)3,据此解答.
解答 解:A是地壳中含量最多的金属元素,则A为Al,Al与NaOH溶液反应生成C单质及乙,则C为H2,乙为NaAlO2.Al与单质B化合生成甲,能与氢氧化钠溶液、盐酸反应,则甲为Al2O3,B为O2,结合转化关系可知,丙为H2O,丁为AlCl3,丁与氨水反应生成戊为Al(OH)3,
(1)由上述分析可知,甲、乙、丁、戊分别为Al2O3、NaAlO2、AlCl3、Al(OH)3,
故答案为:Al2O3、NaAlO2、AlCl3、Al(OH)3;
(2)Al元素处于周期表中第三周期ⅢA,
故答案为:三;ⅢA;
(3)甲→乙+丙反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
A→乙+C反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al2O3+2OH-=2AlO2-+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查无机物的推断,Al为解答本题的突破口,把握Al及其化合物的性质为解答本题的关键,注意氧化铝的两性,题目难度不大.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
16.100mL 6mol•L-1 H2SO4与过量的铁粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成H2的总量,可向反应物中加入适量的( )
| A. | NaHCO3溶液 | B. | KNO3溶液 | C. | 稀醋酸 | D. | Na2SO4溶液 |
14.MTBE是一种重要的汽油添加剂,它是戊醇的同分异构体,且分子内有4个相同的烃基,下列对MTBE的叙述,正确的是( )
| A. | 可与钠反应 | |
| B. | 其同类同分异构体共4种 | |
| C. | 其同类同分异构体共6种(包括其本身) | |
| D. | 完全燃烧时耗氧的质量比本身的质量小 |
10.用石墨作电极,电解1mol•L-1下列物质的溶液,溶液的pH变大的是( )
| A. | H2O | B. | H2SO4 | C. | NaCl | D. | Na2SO4 |