题目内容
4.下列化合物中,含有非极性共价键的离子化合物是( )| A. | Na2O2 | B. | H2SO4 | C. | Ba(OH)2 | D. | N2 |
分析 活泼金属和活泼金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为离子化合物,故A正确;
B.硫酸分子中S-O、O-H原子之间都只存在极性键,为共价化合物,故B错误;
C.氢氧化钡中钡离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物,故C错误;
D.氮气分子中N-N原子之间只存在非极性键,为单质,故D错误;
故选A.
点评 本题考查离子化合物和共价化合物的判断,为高频考点,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,不能根据是否含有金属元素判断离子化合物,如铵盐中只含非金属元素但为离子化合物,注意过氧化钠电子式的书写方法.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
15.分子式为C5H11Cl结构中含2个-CH3的同分异构体有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
12.已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A. | 刺激性气味的气体是氨气 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 | |
| D. | 反应中硫酸作氧化剂 |
19.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
16.关于物质的用途下列说法正确的是( )
| A. | 氢氧化铝可以用做耐火材料 | |
| B. | 铝热反应能放出大量的热,常用于焊接钢轨等 | |
| C. | 铝合金具有密度大、强度高且有一定的抗腐蚀能力,可用于制造能承受强磨损的构件 | |
| D. | 铜被誉为“21世纪的金属”,其应用前景更为广阔 |
13.室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.下列说法正确的是( )
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
14.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现119号元素,请在“元素大厦”中安排好它的“房间”( )
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
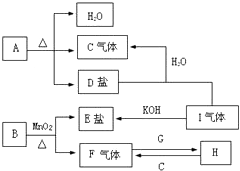 已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题:
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题: