题目内容
14.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现119号元素,请在“元素大厦”中安排好它的“房间”( )| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
分析 根据稀有气体氡的原子序数为86,位于第六周期的零族,而第七周期排满应含有32种元素,以此来分析.
解答 解:因稀有气体氡的原子序数为86,位于第六周期的零族,
第七周期排满应含有32种元素,
则第七周期的稀有气体的原子序数为86+32=118,
则119号元素位于第八周期的第ⅠA,
故选B.
点评 本题考查元素在周期表中的位置,熟悉稀有气体的原子序数及每周期元素的种类数目即可解答,也可利用电子排布来分析.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
4.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | Na2O2 | B. | H2SO4 | C. | Ba(OH)2 | D. | N2 |
5.下列离子方程式正确的是( )
| A. | 向漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 将Na2O2固体投入H218O中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
9.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 6.8 g熔融的KHSO4中含有0.05NA个阳离子 | |
| B. | 1.0 L 2 mol/L的NaOH(aq)中含有的氧原子数目为2NA | |
| C. | 在24 g18O2中含有1.5NA个氧原子 | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
19.下列有机物,既可以发生消去反应,也可以催化氧化为醛的是( )
| A. | C(CH3)3OH | B. | CH3OH | C. | CH3CH(CH3)OH | D. | (CH3)2CHCH2OH |
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol H2O含有的原子数为NA | |
| B. | 4g H2含有氢分子数4NA | |
| C. | 1L 0.1 mol•L-1NaCl溶液中含Na+数0.1NA | |
| D. | 常温常压下,11.2L O2中含有分子数为0.5NA |
18.下列叙述正确的是( )
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | CH3COONa溶液中滴加浓盐酸后c(CH3COO-)增大 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 | |
| D. | 25℃时,pH=3的HCl溶液和pH=11的NaOH溶液中,H2O的电离程度相同 |
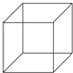 立方烷的结构简式如图所示,每个顶点是一个碳原子.则:
立方烷的结构简式如图所示,每个顶点是一个碳原子.则: