题目内容
11.某有机样品2.2g完全燃烧,燃烧后的混合物通入过量的澄清石灰水中,石灰水共增重6.2g,经过滤得到10g沉淀.则该有机样品可能是( )| A. | 乙醛 | B. | 乙醇 | C. | 乙二醇 | D. | 乙酸 |
分析 石灰水共增重6.2g为烧生成的二氧化碳与水的质量,10g沉淀为碳酸钙的质量,
有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据质量守恒判断有机物中是否含有氧元素,根据原子守恒计算有机物的最简式,结合选项判断.
解答 解:l0g沉淀为CaCO3,物质的量为:$\frac{10g}{100g/mol}$=0.1mol,
根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为:0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,
石灰水增重6.2g,所以有机物燃烧生成的水的质量为:6.2g-4.4g=1.8g,其物质的量为:$\frac{1.8g}{18g/mol}$=0.1mol,氢元素质量为0.2mol×1g/mol=0.2g,
有机样品共2.2g,所以O元素物质的质量=2.2g-1.2g-0.2g=0.8g,氧原子物质的量为:$\frac{0.8g}{16g/mol}$=0.05mol,
即2.2g有机物中n(C)=0.1mol,n(H)=0.1mol×2=0.1mol,n(O)=0.05mol,碳、氢、氧原子的物质的量之比为0.1mol:0.2mol:0.05mol=2:4:1,即最简式为C2H4O,
选项中只有乙醛符合,
故选A.
点评 本题考查有机物分子式的确定,题目难度中等,根据质量守恒确定有机物的是否含有氧元素是关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.实验测得角鲨烯分子是链状结构,分子中含有30个碳原子且碳、氢元素质量比为7.2:1,下列说法中不正确的是( )
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯与分子式为C29H48的物质可能属于同系物 | |
| C. | 角鲨烯完全加氢后为C30H62 | |
| D. | 1mol角鲨烯最多可与5mol溴单质加成 |
2. (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
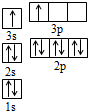
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了能量最低原理.
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4>H3PO4; HClO4>HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为直线形.
6.乙醇与乙酸反应生成乙酸乙酯时,乙酸分子断裂的化学键为( )
| A. | 碳氢键 | B. | 碳碳键 | C. | 氢氧键 | D. | 碳氧单键 |
16.下列根据物质组成推断相关信息,正确的是( )
| A. | 过二硫酸钾的化学式为K2S2O8,其中硫元素为+6价 | |
| B. | KMnO4和K2MnO4中原子团组成相同,其化学性质相同 | |
| C. | 有机物的分子式、结构简式、实验式都不相同 | |
| D. | 摩尔质量相同的物质,其化学式一定相同 |
8.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
| A. | Fe(OH)2跟稀硝酸反应 | B. | Fe2O3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Al(OH)3跟稀硝酸反应 |

 +6KMnO4+9H2SO4→
+6KMnO4+9H2SO4→ +3K2SO4+6MnSO4+14H2O.
+3K2SO4+6MnSO4+14H2O.