题目内容
【题目】为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
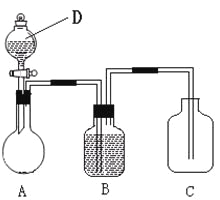
请据此实验回答下列问题:
(1)仪器D的名称是____________,所盛放的试剂应为___________(填化学式);
(2)在烧瓶中装某可溶性正盐溶液,则A中反应的离子方程式是______________;
(3)装置B中所盛的试剂是_____________,其作用是___________________;
(4)装置C中所盛的试剂是________,C中反应的化学方程式是____________;
(5)根据该实验可以得出C6H5OH、H2CO3、CH3COOH这三种物质的酸性强弱顺序为
______________________。
【答案】分液漏斗 CH3COOH 2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ 饱和NaHCO3溶液 除去CO2气体中混有的醋酸杂质 苯酚钠溶液 C6H5ONa+H2O+CO2=C6H5OH+NaHCO3 CH3COOH>H2CO3>C6H5OH
【解析】
根据强酸制取弱酸知中,强酸能和弱酸盐反应生成弱酸(酸相对强弱),弱酸能制取更弱的酸,要想验证C6H5OH、H2CO3、CH3COOH的酸性强弱,用CH3COOH和碳酸盐反应制取二氧化碳,用二氧化碳和苯酚的可溶性盐制取苯酚,根据实验现象确定酸的相对强弱。
(1)仪器D为分液漏斗,应盛放CH3COOH,以CH3COOH与碳酸盐反应生成二氧化碳,证明CH3COOH酸性强于碳酸酸性;
(2)用CH3COOH和在烧瓶中装的某可溶性正盐溶液反应制取二氧化碳,醋酸是弱酸,应该写化学式,发生反应的离子反应方程式为2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑;
(3)醋酸有挥发性,使得反应产生的CO2气体中含有醋酸,对实验造成干扰,因此B装置要盛放能除去醋酸,且不与CO2反应,也不能产生新的杂质的物质,一般常用饱和碳酸氢钠溶液;
(4)CO2和苯酚钠溶液反应生成不溶性的苯酚,所以C选用苯酚钠溶液,反应方程式为C6H5ONa+H2O+CO2=C6H5OH+NaHCO3;
(5)由于CH3COOH能与碳酸盐反应生成二氧化碳,说明酸性:CH3COOH>H2CO3;二氧化碳能与苯酚钠反应生成C6H5OH,说明酸性:H2CO3>C6H5OH;所以酸性有强到弱的顺序为:CH3COOH>H2CO3>C6H5OH。