题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
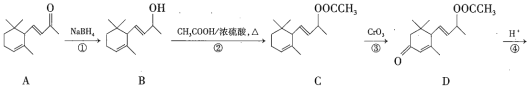
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
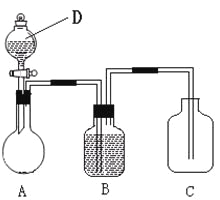
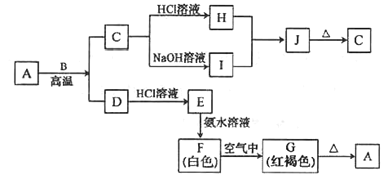
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
【答案】第三周期第ⅦA族 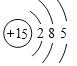 离子键、非极性共价键 AC 32
离子键、非极性共价键 AC 32 ![]()
![]()
![]()
![]()
【解析】
浓度均为0.01mol/L的溶液,X、R的最高价氧化物对应的水化物pH=2,X、R的最高价氧化物的水化物为一元强酸,Y的最高价氧化物对应的水化物pH=12,Y的最高价氧化物的水化物为一元强碱,Z的最高价氧化物的水化物的pH>2且溶液呈酸性,Z的最高价氧化物的水化物为弱酸,W的最高价氧化物的水化物的pH<2,W的最高价氧化物的水化物为多元强酸,结合原子序数的关系,所以X、Y、Z、W、R分别为N、Na、P、S、Cl元素。
![]() 元素Cl在周期表中的位置是第三周期第ⅦA族,磷原子结构示意图为
元素Cl在周期表中的位置是第三周期第ⅦA族,磷原子结构示意图为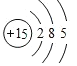 ,
,
故答案为:第三周期第ⅦA族; ;
;
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物为
型化合物为![]() ,其电子式为:
,其电子式为:![]() ,含有离子键、非极性共价键,
,含有离子键、非极性共价键,
故答案为:离子键、非极性共价键;
II(1)A.S与H2发生化合反应比C与H2化合更容易,能证明非金属性![]() ,故A正确;
,故A正确;
B.酸性:![]() ,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故B错误;
C.CS2中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价,说明硫原子对共用电子对的吸引力较强,说明非金属性:
价,说明硫原子对共用电子对的吸引力较强,说明非金属性:![]() ,故C正确;
,故C正确;
故答案为:AC;
(2)①锗在硅元素的下一周期,二者原子序数之差为18,故锗的原子序数为![]() ,
,
故答案为:32;
②同主族自上而下金属性增强,金属性越强,它们![]() 价氢氧化物的碱性越强,故碱性由强到弱顺序为:
价氢氧化物的碱性越强,故碱性由强到弱顺序为:![]() ,
,
故答案为:![]() ;
;
(3)①COS分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构,则C与O、C与S均形成两对共用电子对,用电子式表示羰基硫分子的形成过程为![]() ,
,
故答案为:![]() ;
;
![]() 由图示可知生成正盐为
由图示可知生成正盐为![]() ,由元素守恒可知,生成正盐还有
,由元素守恒可知,生成正盐还有![]() ,反应为
,反应为![]() ,硫化钠与水反应生成
,硫化钠与水反应生成![]() ,S元素的化合价升高,则生成的气体a为还原产物氢气,结合原子守恒还有氢氧化钠生成,其反应的离子方程式为:
,S元素的化合价升高,则生成的气体a为还原产物氢气,结合原子守恒还有氢氧化钠生成,其反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;![]() 。
。