题目内容
【题目】[化学—选修3:物质结构与性质]国务院批复通过的《全国矿产资源规划(2016﹣﹣2020年)》中,首次将萤石等24种矿产列入战略性矿产目录。萤石为氟化钙的俗名,其重要用途是生产氢氟酸。
(1)基态F原子核外电子共有_____种运动状态,基态Ca2+的最外层电子排布图为_____。
(2)实验室制氟化氢是用萤石与浓硫酸反应,但该反应不可以在玻璃器皿中进行,请用化学反应方程式解释原因_____,该反应涉及的元素电负性最大的是_____(用元素符号表示)。该反应的产物之一会与反应物继续反应生成H2SiF6,则H2SiF6分子的中心原子价层电子对数为_____。
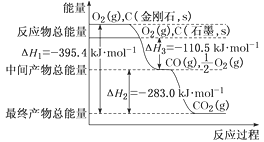
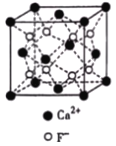
(3)CaF2与CaCl2熔点比较低的物质是_____,原因是_______________。CaF2晶胞如图,其中Ca2+的配位数为_____。在CaF2晶体中Ca2+的离子半径为a cm,F﹣的离子半径为bcm;则CaF2的密度为_____gcm﹣3(设阿伏加德罗常数的值为NA)。
【答案】9 ![]() SiO2+4HF=SiF4↑+2H2O F 6 CaCl2 二者均为离子晶体,Cl﹣半径大于F-,则CaCl2的晶格能大于CaF2的晶格能 8
SiO2+4HF=SiF4↑+2H2O F 6 CaCl2 二者均为离子晶体,Cl﹣半径大于F-,则CaCl2的晶格能大于CaF2的晶格能 8 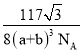
【解析】
(1)基态F原子含有9个核外电子,每个电子的运动状态不同;基态Ca2+的排布式为1s22s22p63s23p6;
(2)氢氟酸能与二氧化硅反应生成四氟化硅气体和水;反应涉及元素有H、O、F、Si;H2SiF6与SiF62-中心原子价层电子对数相同;
(3)离子晶体,离子半径越小,晶格能越大,熔点越高; 根据晶胞结构,一个Ca2+离子距离相等且最近的F-有8个;根据ρ=![]() 计算。
计算。
(1)基态F原子含有9个核外电子,每个电子的运动状态不同,则有9种种运动状态;基态Ca2+的排布式为1s22s22p63s23p6,最外层为第三层,则排布图为![]() ;
;
(2)氢氟酸能与二氧化硅反应生成四氟化硅气体和水,方程式为SiO2+4HF=SiF4↑+2H2O;反应涉及元素有H、O、F、Si,电负性最大的为F;H2SiF6与SiF62-中心原子价层电子对数相同,则中心Si原子的孤电子对数=![]() (4+2-1×6)=0,无孤电子对,只含有6条共价键,则中心原子价层电子对数为6;
(4+2-1×6)=0,无孤电子对,只含有6条共价键,则中心原子价层电子对数为6;
(3)CaF2与CaCl2均为离子晶体, r(F-)<r(Cl-),离子半径越小,晶格能越大,熔点越高,则CaCl2的熔点较低; 根据晶胞结构,一个F-周围距离最近且相等的Ca2+离子有4个,则一个Ca2+离子距离相等且最近的F-有8个,则配位数为8;Ca2+在顶点和面心,N(Ca2+)=8×![]() +6×
+6×![]() =4,F-在晶胞内,个数为8,根据晶胞结构,体对角线=4×(a+b),则V=
=4,F-在晶胞内,个数为8,根据晶胞结构,体对角线=4×(a+b),则V=![]() ,
,![]() =
=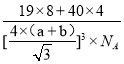 =
=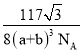 。
。

 阅读快车系列答案
阅读快车系列答案