题目内容
工业合成氨的反应为:N2(g)+3H2(g)  2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
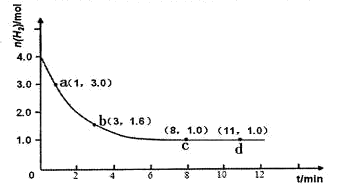
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
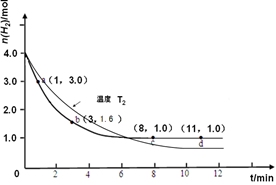
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随
反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:

写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO其反应为:CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随
反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:

写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO其反应为:CH3COO[Cu(NH3)2]+CO+NH3
 CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。(16分)(1)0.080mol/(L·min) (3分,单位漏扣1分)
(2)(共5分)解:依题意,平衡时H2的浓度为0.10 mol/L,则
N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
起始浓度(mol/L) 0.30 0.40 0
转化浓度(mol/L) 0.10 0.30 0.20
平衡浓度(mol/L) 0.20 0.10 0.20 (1分)
K= =
=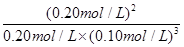 =2.0×102 (L/mol)2
=2.0×102 (L/mol)2
(4分,其中代入公式、代入数值各1分;结果2分,代入数值不带单位不扣分,有效数字错误扣1分。)
(3)(2分,注意曲线起点、斜率、平衡点(t>8min,n(H2)<1.0mol)要素有错,每个要素扣1分,不标注温度扣1分直至0分,)
(4)CO(g)+H2O(g)==CO2(g)+H2(g) ΔH="+2.8" kJ/mol
(4分,状态错漏该小题0分,其中:方程式2分,ΔH 2分,错漏单位扣1分。其他计量数,合理即给分)
(5)高压,低温,加入浓氨水 ,增大醋酸二氨合铜(Ⅰ)溶液浓度,及时分离CH3COO[Cu(NH3)3]·CO等任写一点,用催化剂不给分(2分,合理即给分)
(2)(共5分)解:依题意,平衡时H2的浓度为0.10 mol/L,则
N2(g) + 3H2(g)
 2NH3(g)
2NH3(g)起始浓度(mol/L) 0.30 0.40 0
转化浓度(mol/L) 0.10 0.30 0.20
平衡浓度(mol/L) 0.20 0.10 0.20 (1分)
K=
 =
=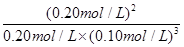 =2.0×102 (L/mol)2
=2.0×102 (L/mol)2(4分,其中代入公式、代入数值各1分;结果2分,代入数值不带单位不扣分,有效数字错误扣1分。)
(3)(2分,注意曲线起点、斜率、平衡点(t>8min,n(H2)<1.0mol)要素有错,每个要素扣1分,不标注温度扣1分直至0分,)

(4)CO(g)+H2O(g)==CO2(g)+H2(g) ΔH="+2.8" kJ/mol
(4分,状态错漏该小题0分,其中:方程式2分,ΔH 2分,错漏单位扣1分。其他计量数,合理即给分)
(5)高压,低温,加入浓氨水 ,增大醋酸二氨合铜(Ⅰ)溶液浓度,及时分离CH3COO[Cu(NH3)3]·CO等任写一点,用催化剂不给分(2分,合理即给分)
试题分析:(1)读图可知,氢气的物质的量从4.0mol减小到1.6mol,则v(H2)=
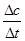 =
=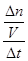 =
=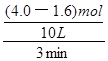 =0.080mol/(L?min),注意要保留两位有效数字;(2)图中氢气平衡时的物质的量为1.0mol,由于c=n/V,则氢气的平衡浓度为0.10mol/L,则
=0.080mol/(L?min),注意要保留两位有效数字;(2)图中氢气平衡时的物质的量为1.0mol,由于c=n/V,则氢气的平衡浓度为0.10mol/L,则N2(g) + 3H2(g)
 2NH3(g)
2NH3(g)起始浓度(mol/L) 0.30 0.40 0
转化浓度(mol/L) 0.10 0.30 0.20
平衡浓度(mol/L) 0.20 0.10 0.20 (1分)
K=
 =
=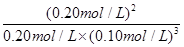 =2.0×102 (L/mol)2
=2.0×102 (L/mol)2(3)焓变小于0,说明合成氨是放热反应,其它条件相同时,降低温度,反应速率减小,平衡向正反应方向移动,则达到平衡的时间比原平衡时增大,平衡时氢气的物质的量比原平衡时减小,由此可以画出T2时氢气的物质的量随反应时间变化的曲线;(4)先给已知反应编号为①②,观察可知,反应①—②可以约去1/2O2(g),根据盖斯定律可得:CO(g)+H2O(g)==CO2(g)+H2(g) ΔH="+2.8" kJ/mol;(5)由于正反应是气体体积减小的放热反应,根据外界条件对平衡移动的影响规律,降低温度、增大醋酸二氨合铜(I)或氨气的浓度、减小CH3COO[Cu(NH3)3]?CO的浓度或及时移走CH3COO[Cu(NH3)3]?CO,都能使平衡右移,上述措施可以提高CO吸收率。

练习册系列答案
相关题目
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
 SO3(g) +NO(g),
SO3(g) +NO(g),

 CH3OH(g)
CH3OH(g)

 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)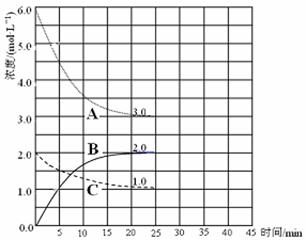
 2CO(g) △H1;
2CO(g) △H1; 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):

 2NO(g)
2NO(g)  H>0
H>0