题目内容
为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为 。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
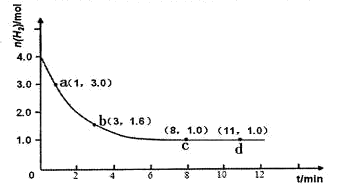
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
(1)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为 。
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①该反应的平衡常数表达式K= ;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)= (注明单位);H2的转化率= ;
③下列说法中,能说明上述反应达到平衡状态的是
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1∶3∶1∶1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
(1)CH3OH(l)+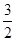 O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)
O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)
(其中化学方程式完全正确 给2分、 △H=-726.6 J/mol 给1分)
(2)①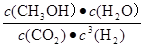 ( 2分)
( 2分)
②0.075 mol·(L·min)-1 ( 2分,计算结果1分、单位1分);75% (2分)
③C (3分) ④ BD (4分,全对得4分,选一个对得2分,其它错误不得分)
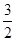 O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)
O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol ( 3分)(其中化学方程式完全正确 给2分、 △H=-726.6 J/mol 给1分)
(2)①
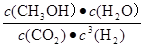 ( 2分)
( 2分)②0.075 mol·(L·min)-1 ( 2分,计算结果1分、单位1分);75% (2分)
③C (3分) ④ BD (4分,全对得4分,选一个对得2分,其它错误不得分)
试题分析:(1)由m/M可知,n(CH3OH)=1/2mol,则1/2 CH3OH (l)+3/4O2(g)==1/2CO2(g)+H2O(l) △H=—363.3kJ/mol,系数加倍可得,CH3OH(l)+
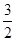 O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol;(2)①K=
O 2(g)=CO2(g)+2H2O(l) △H=-726.6kJ/mol;(2)①K=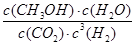 ;②读图可知,v(CH3OH)=
;②读图可知,v(CH3OH)=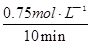 =0.075mol?L—1?min—1;由于v(H2)="3" v(CH3OH)= 0.225mol?L—1?min—1,则△n(H2)= 0.225mol?L—1?min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
=0.075mol?L—1?min—1;由于v(H2)="3" v(CH3OH)= 0.225mol?L—1?min—1,则△n(H2)= 0.225mol?L—1?min—1×10min×1L=2.25mol,H2的转化率=2.25/3×100%=75%;③均为正反应速率,故A错;不能说明各组分的物质的量保持不变,故B错;能说明各组分的物质的量保持不变,故C正确;由于各组分都是气体且恒容,则混合气体的密度始终不变,故D错;④正反应放热,升高温度平衡左移,故A错;减小生成物浓度,平衡右移,故B正确;催化剂不能使平衡移动,故C错;相当于增大压强,正反应气体体积减小,则平衡右移,故D正确。
练习册系列答案
相关题目


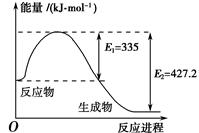
 2NH3(g) ΔH=a kJ·mol-1。
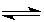
2NH3(g) ΔH=a kJ·mol-1。 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
 .
. 、一283.0 kJ
、一283.0 kJ 、
、 均大于300℃):
均大于300℃):
 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
 增大
增大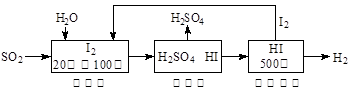
 Ni(OH)2+M
Ni(OH)2+M N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。