题目内容
根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。

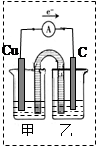
(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)

(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断该试样的酸碱性为 ,试样的pH值=
②已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g)  H>0
H>0
若1 mol空气含有0.8 molN2和0.2 molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8 × 10-4 mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(1)化学反应可视为旧键断裂和新键生成的过程。键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和其燃烧产物P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360, O-O:498,白磷(P4)燃烧的热化学方程式为 。

(2)化学能与电能之间可以相互转化,以Fe、Cu、C(石墨)、CuSO4溶液、FeSO4溶液、Fe2(SO4)3溶液 、AgNO3溶液为原料,通过原电池反应实现2Fe3+ + Cu=2Fe2+ + Cu2+,请你把下图补充完整,使之形成闭合回路,并用元素符号标明电极。甲池中电解液是 溶液;乙池中电解液是 溶液。(要求:甲、乙两池中电解质元素种类始终保持不变)

(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
②已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g)  H>0
H>0若1 mol空气含有0.8 molN2和0.2 molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8 × 10-4 mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(1)P4(s) + 3O2(g) =P4O6(s) △H=-1638kJ·mol-1(3分)
(2)甲池:CuSO4(1分) ;乙池:Fe2(SO4)3(1分),图像正确得2分。
(3)①酸性,4 (3分)
②4×10-6 ;该反应为吸热反应,温度升高,反应速率加快,平衡右移 (4分)
(2)甲池:CuSO4(1分) ;乙池:Fe2(SO4)3(1分),图像正确得2分。

(3)①酸性,4 (3分)
②4×10-6 ;该反应为吸热反应,温度升高,反应速率加快,平衡右移 (4分)
试题分析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据题意可知,该反应的反应热△H=198kJ/mol×6+498kJ/mol×3-360kJ/mol×12=-1638kJ/mol,所以该反应的热化学方程式是P4(s) + 3O2(g) =P4O6(s) △H=-1638kJ/mol。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铜是还原剂,作负极。正极是溶液中的铁离子得到电子。所以根据电子的流向可知,甲中电极是负极,可选择铜做电极,电解质是硫酸铜。乙中电极是正极,可选择石墨作电极,电解质是硫酸铁。
(3)①根据溶液显中性可知,溶液中氢离子的物质的量浓度是4×10-5mol/L×2+3×10-5mol/L+2×10-5mol/L-4×10-6mol/L-6×10-6mol/L-2×10-5mol/L=1×10-4mol/L,则溶液的pH=4。
②反应前后体积不变,则可以设容器体积是1L,则
N2(g) + O2(g)
 2NO(g)
2NO(g)起始浓度(mol/L) 0.8 0.2 0
转化浓度(mol/L) 4×10-4 4×10-4 8×10-4
平衡浓度(mol/L) 0.8 0.2 8×10-4
所以该温度下的平衡常数K=
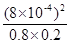 =4×10-6
=4×10-6由于该反应为吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,所以气缸温度越高,单位时间内NO排放量越大。
点评:该题是高考中的常见题型,试题针对性强,贴近高考,有利于调动学生的学习兴趣,激发学生的学习积极性,有利于培养学生的逻辑推理能力和抽象思维能力。也有助于培养学生的环境保护意识和能源节约意识。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。

 2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,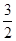 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1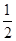 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3