题目内容
除去杂质后的水煤气主要含H2、CO,是理想的合成甲醇的原料气。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g) 2CO(g) △H1;
2CO(g) △H1;
②CO(g)+H2O(g) H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g) CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;
上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g) 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
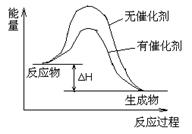
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)
 2CO(g) △H1;
2CO(g) △H1;②CO(g)+H2O(g)
 H2(g)+CO2(g) △H2;③C(s)+H2O(g)
H2(g)+CO2(g) △H2;③C(s)+H2O(g) CO(g)+H2(g) △H3;
CO(g)+H2(g) △H3;上述反应△H3与△H1、△H2之间的关系为 。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:2CH4(g)+3O2(g)
 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):①X在750℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 ;
(3)请在答题卡中,画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)合成气合成甲醇的主要反应是:2H2(g)+CO(g)
 CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。
CH3OH(g) △H=-90.8kJ·mol-1,T℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.20 | 0.10 | 0.40 |
①该时间段内平均反应速率v(H2)= 。
②比较此时正、逆反应速率的大小:v(正) v (逆)(填“>”、“<”或“=”)
(5)生产过程中,合成气要进行循环,其目的是 。
(16分)
(1)△H3=△H1+△H2(2分)
(2)Z(2分) 催化效率高且活性温度低,节能(或催化活性高、速度快,反应温度低)(3分)
(3)画图如下(3分):
(4)①0.080 mol·L-1·min-1 (2分) ②>(2分)
(5)提高原料利用率(或提高产量、产率也可)(2分)
(1)△H3=△H1+△H2(2分)
(2)Z(2分) 催化效率高且活性温度低,节能(或催化活性高、速度快,反应温度低)(3分)
(3)画图如下(3分):

(4)①0.080 mol·L-1·min-1 (2分) ②>(2分)
(5)提高原料利用率(或提高产量、产率也可)(2分)
试题分析:(1)观察3个热化学方程式,发现①+②=③,根据盖斯定律,△H3=△H1+△H2;(2)正反应是放热反应,升高温度平衡向逆反应方向移动,不利于甲烷转化为CO,因此选择Z催化剂,因为催化效率高且活性温度低,节能(或催化活性高、速度快,反应温度低);(3)画图要点:反应物的总能量高于生成物的总能量;无催化剂时正、逆反应的活化能较高;催化剂能降低正、逆反应的活化能,对焓变、反应物或生成物的总能量无影响,有催化剂时正、逆反应的活化能较低;标注反应物、生成物、△H、无催化剂、有催化剂;(4)①先用定义式求v(CH3OH),再用系数之必等于速率之比求v(H2),即v(CH3OH)=△c(CH3OH)/△t=(0.40—0)mol/L÷10min=0.040mol/(L?min),由于v(H2)/v(CH3OH)=2/1,则v(H2)=2v(CH3OH)= 0.080mol/(L?min),保留两位有效数字;②此时c(CH3OH)/[ c2(H2)?c(CO)]=0.40/[0.202×0.10]=100,由于100<K=160,为了能达到该温度下的平衡常数,说明该反应向正反应方向进行,即v(正)> v(逆);(5)合成气循环利用的目的是提高原料利用率(或提高产量、产率也可)。

练习册系列答案
相关题目
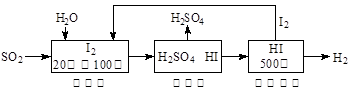
 Ni(OH)2+M
Ni(OH)2+M X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。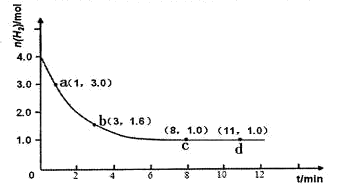

 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)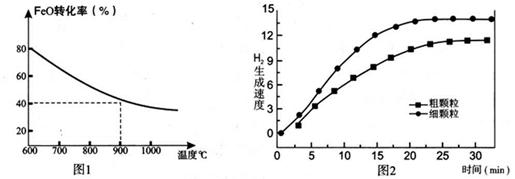
 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1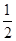 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3