��Ŀ����
Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)+3H2(g) 2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l)
2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
��1��������ȼ���ȡ�H=_______________kJ/mol��
��2���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ���� ��
��3���ں��º���װ���н��кϳɰ���Ӧ�������Ũ��-ʱ��ͼ�����¡�
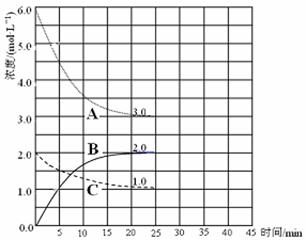
�� ��ʾN2Ũ�ȱ仯�������� ��
�� ǰ25 min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ��
�� ��25 minĩ�պ�ƽ�⣬��ƽ�ⳣ��K = ��
��4���ڵ�25 min ĩ�����������������䣬�����¶ȣ��ڵ�35 minĩ�ٴ�ƽ�⡣ƽ���ƶ�������H2Ũ�ȱ仯��1.5 mol��L��1����ͼ�л�����25 min �� 40 min NH3Ũ�ȱ仯���ߡ�
��5����֪�����£�NH4+ ��ˮ�ⳣ��Ϊ1.0��10��9����0.1mol/L NH4Cl��ҺpH= ��������NH4+ˮ���NH4+Ũ�ȵ�Ӱ�죩
 2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l)
2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol����1��������ȼ���ȡ�H=_______________kJ/mol��
��2���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ���� ��
| A������������ٱ仯������ƽ�� |
| B�������ܶȲ��ٱ仯����δƽ�� |
| C��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ� |
| D��ƽ���ѹ��װ�ã����ɸ���NH3 |

�� ��ʾN2Ũ�ȱ仯�������� ��
�� ǰ25 min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ��
�� ��25 minĩ�պ�ƽ�⣬��ƽ�ⳣ��K = ��
��4���ڵ�25 min ĩ�����������������䣬�����¶ȣ��ڵ�35 minĩ�ٴ�ƽ�⡣ƽ���ƶ�������H2Ũ�ȱ仯��1.5 mol��L��1����ͼ�л�����25 min �� 40 min NH3Ũ�ȱ仯���ߡ�
��5����֪�����£�NH4+ ��ˮ�ⳣ��Ϊ1.0��10��9����0.1mol/L NH4Cl��ҺpH= ��������NH4+ˮ���NH4+Ũ�ȵ�Ӱ�죩
��16�֣�
��1����286.0 ��2�֣���д��������1�֣�
��2��AD ��2�֣�
��3���� C ��2�֣�
�� 0.12 mol / (L��min) ��3�֣�����2�֣���λ1�֣�
�� 0.15 ��2�֣�
��4�� ��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
��5�� 5 ��2�֣�
��1����286.0 ��2�֣���д��������1�֣�
��2��AD ��2�֣�
��3���� C ��2�֣�
�� 0.12 mol / (L��min) ��3�֣�����2�֣���λ1�֣�
�� 0.15 ��2�֣�
��4��
 ��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
��3�֣����1�֣��յ�1�֣��ӳ���1�֣���5�� 5 ��2�֣�
�����������1���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڣ��ٸ��ݸ�˹���ɣ���(�١�2����)/3�ɵã�2H2(g)+O2(g)= 2H2O(l) ��H=��572.0kJ /mol�����ϵ�����룬���ʱ���֮���룬��H2(g)+O2(g)= 2H2O(l) ��H=��286.0kJ /mol������ȼ���ȸ���ɵã�������ȼ���ȡ�H=��286.0kJ /mol����2�����º�ѹ�£�����Ħ�������ͬ������n=V/Vm��������������ٱ仯��������������ʵ������ٱ仯��˵����Ӧ�Ѵ�ƽ�⣬��A��ȷ�������ܶȵ�����������������������������������غ㶨�ɿ�֪��������ʼ�ղ��䣬�������ܶȲ��ٱ仯ʱ����������������䣬��������ʵ������䣬˵����Ӧ�Ѵ�ƽ�⣬��B����ƽ������������壬ά�ֺ��º�ѹ���������������ݻ�����С�����Ũ�ȣ���ʵ���Ǽ�Сѹǿ��ƽ�����淴Ӧ�������������������ƶ�����C����ƽ���ѹ��װ�ã���С�����ݻ�����ʵ��������ѹǿ��ƽ��������Ӧ��������������С�����ƶ�����D��ȷ����3���ٺϳɰ���ԭ��ΪN2(g)+3H2(g)
 2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã�
2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã�N2(g)+3H2(g)
 2NH3(g)
2NH3(g)����ֵ���ʼŨ��/ mol��L��1 2.0 6.0 0
����ֵı仯Ũ��/ mol��L��1 1.0 3.0 2.0
����ֵ�ƽ��Ũ��/ mol��L��1 1.0 3.0 2.0
K=
 =
= ��0.15��������λ��Ч���֣�
��0.15��������λ��Ч���֣���4�����ںϳɰ�������Ӧ�ġ�H=��93.0kJ /mol��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����ƽ�����淴Ӧ�����ƶ�����Ӧ��Ũ��������Ũ�ȼ�С�������������ݷ��ɵã�
N2(g)+3H2(g)
 2NH3(g)
2NH3(g)25minʱ�����Ũ��/ mol��L��1 1.0 3.0 2.0
����ֵı仯Ũ��/ mol��L��1 0.5 1.5 1.0
35minʱ�����Ũ��/ mol��L��1 1.5 4.5 1.0
��ˣ�25min��35min������Ũ����2.0mol/L��СΪ1.0mol/L��35min��40min������Ũ��Ϊ1.0mol/L��ʼ�ձ��ֲ��䣻��5���Ȼ����ǿ�������Σ�����ȫ�������笠����Ӳ���ˮ�⣬����һˮ�ϰ��������ӣ�����ˮ��ƽ�⣬����Һ��������Ũ��Ϊxmol/L�����������ݷ��ɵã�
NH4++H2O
 NH3?H2O+H+
NH3?H2O+H+����ֵ���ʼŨ��/ mol��L��1 0.1 0 0
����ֵı仯Ũ��/ mol��L��1 x x x
����ֵ�ƽ��Ũ��/ mol��L��1 0.1��x x x
K=
 =
= =1.0��10��9
=1.0��10��9����笠�����ˮ��̶Ⱥ�С����0.1��x��0.1����
 =
= =1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��
=1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��
��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 CO(g) + 3H2(g) ��H =" +206.2" kJ/mol
CO(g) + 3H2(g) ��H =" +206.2" kJ/mol CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£� ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�

 ��
�� ��һ283.0 kJ
��һ283.0 kJ ��
�� ������300�棩��
������300�棩��
 ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
 ����
���� H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1
H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1 �Ħ�HΪ��384 kJ��mol-1
�Ħ�HΪ��384 kJ��mol-1 2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��
2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��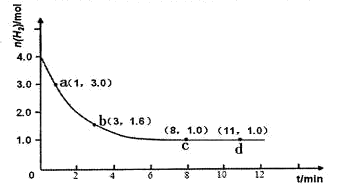

 2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%��
2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%�� ��
�� ��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����
��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����
 2NH3(g)��H=+92kJ/mol
2NH3(g)��H=+92kJ/mol �����Ǽ������ʱ�������仯����
�����Ǽ������ʱ�������仯���� N2(g)+3H2(g) ��H=+92kJ/mol
N2(g)+3H2(g) ��H=+92kJ/mol