题目内容
【题目】按要求回答下列问题:
(1)已知:氢气的燃烧热ΔH=-285.8 kJ/mol,则氢气燃烧的热化学方程式可表示为_____。
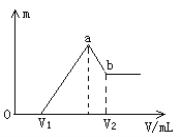
(2)如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,此反应的热化学方程式为________________。
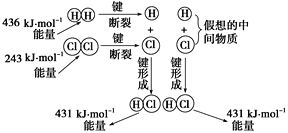
(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
【答案】 2H2(g) + O2(g)=2H2O(l) ΔH=-571.6 kJ/mol H2(g) + Cl2(g)=2HCl(g) ΔH=-183 kJ/mol -117.6
【解析】⑴. 已知氢气的燃烧热ΔH=-285.8 kJ/mol,根据燃烧热的定义可知,2mol氢气完全燃烧生成液态水放出的热量为285.8kJ×2=571.6 kJ,则氢气燃烧的热化学方程式可表示为2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol,故答案为:2H2(g) + O2(g)
2H2O(l) ΔH=-571.6 kJ/mol,故答案为:2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol;
2H2O(l) ΔH=-571.6 kJ/mol;
⑵. 对应化学反应H2(g) + Cl2(g)![]() 2HCl(g),△H=反应物的键能总和-生成物的键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则此反应的热化学方程式为:H2(g) + Cl2(g)
2HCl(g),△H=反应物的键能总和-生成物的键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则此反应的热化学方程式为:H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol,故答案为:H2(g) + Cl2(g)
2HCl(g) ΔH=-183 kJ/mol,故答案为:H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol;
2HCl(g) ΔH=-183 kJ/mol;
⑶.已知:① 2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol
2H2O(l) ΔH=-571.6 kJ/mol
② H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol
2HCl(g) ΔH=-183 kJ/mol
③ H2O (g)![]() H2O(l) ΔH=-44 kJ/mol
H2O(l) ΔH=-44 kJ/mol
根据盖斯定律可知,①-②×2-③×2得4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-117.6kJ/mol,故答案为:-117.6kJ/mol。
2Cl2(g)+2H2O(g) ΔH=-117.6kJ/mol,故答案为:-117.6kJ/mol。

 高效智能课时作业系列答案
高效智能课时作业系列答案