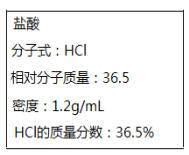
题目内容
【题目】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6gB.6.4gC.12.8gD.1.6g
【答案】C
【解析】
由题目可知,n(O2)=0.1mol,
设Cu、Au的物质的量分别为x、y,则
根据电子守恒列方程:
2x=0.1mol×4
计算得出:x=0.2mol
m(Cu)=0.2mol×64g/mol=12.8g,所以C选项正确。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
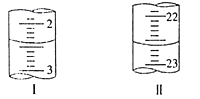
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
【题目】恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是
A. 0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B. 4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C. 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D. 若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol