��Ŀ����
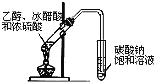
����Ŀ����Ũ����Ͷ���������������ʵ��װ����ͼ��ʾ��

(1)��������ʵ�����Ʊ�ʱ����������ͬ����װ�õ��� _______
A.O2 B. H2 C.HCl D. CO2
(2)�Ƶõ������л������Ȼ������ʣ���ͨ��װ��______��ϴ��ƿ��ȥ��
(3)��ҵ�Ͻ�����ͨ��ʯ����[Ca(OH)2]��ȡƯ�ۣ���ѧ��Ӧ����ʽΪ___________��Ư���ڿ����к����ױ��ʣ���д��Ư���ڿ����б��ʵķ�Ӧ����ʽ____��
(4)�ݱ������ճ������У������Һ(��Ҫ�ɷ���HCl)��84����Һ(��Ҫ�ɷ��Ǵ�������)���ʹ�ûᷢ���ж����¹ʣ������ж���������д����Ӧ�Ļ�ѧ����ʽ______��
(5)�������̺�����ض���ǿ�����������ɽ�Ũ��������Ϊ��������Ũ�����������������ķ�Ӧ����ʽ���£� KMnO4 + HCl= KCl + MnCl2 + Cl2��+ H2O
����ƽ�÷�Ӧ�Ļ�ѧ����ʽ______��
���á������š�����������ʽ�ϱ������ת�Ƶķ������Ŀ______���÷�Ӧ��______Ԫ�ر����������������õ�HCl��______mol������1mol����ת��ʱ������������(��״̬��)______ ����
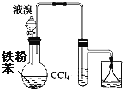
(6)(��ͼ)��������һ���Ľ�ʵ�顣��ѹ������ƿ����װ�й���B����ƿ�м�����ҺA��ͬʱ��ȼ�չ���ͨ������C����ȼ�����Կ������Ե�ȼ������(���������Է�ֹ�����ϱ�ը)��

���ô�װ��ģ�ҵ�ϳ����ᡣ����Ӧ�Լ�ѡ����ȷ����_________(ѡ�����)��
��ҺA | ����B | ����C | |
a | ϡ���� | Zn | Cl2 |
b | Ũ���� | MnO2 | H2 |
c | ϡ���� | Fe | Cl2 |
d | Ũ���� | KMnO4 | H2 |
���ܿڿɹ۲쵽��������__________��
���𰸡�C ����ʳ��ˮ 2Cl2 + Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O Ca(ClO)2 + 2CO2 + 2H2O=Ca(HCO3)2+ 2HClO 2HClO![]() 2HCl+ O2�� 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
2HCl+ O2�� 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O ![]() ��Ԫ�� 6 11.2 d ��ɫ���棬�ܿ��Ϸ��а���
��Ԫ�� 6 11.2 d ��ɫ���棬�ܿ��Ϸ��а���
��������
ʵ������Ũ����Ͷ������̷�Ӧ�������ķ���װ��Ϊ������+Һ̬![]() ���壻���ñ���ʳ��ˮ��ȥHCl�����Խ��������ܽ�ȣ����⣨6����װ��ģ�ҵ�ϳ����ᣬ����ȼ�չܿڴ���������������Ӧ����HCl��ͨ������CΪ��������ƿ�����ɵ�����Ϊ���������Ʊ������ķ�Ӧ����Ҫ���ȡ�
���壻���ñ���ʳ��ˮ��ȥHCl�����Խ��������ܽ�ȣ����⣨6����װ��ģ�ҵ�ϳ����ᣬ����ȼ�չܿڴ���������������Ӧ����HCl��ͨ������CΪ��������ƿ�����ɵ�����Ϊ���������Ʊ������ķ�Ӧ����Ҫ���ȡ�
��1���÷���װ��Ϊ��������Һ̬�����Ʊ����壬��ʵ�����Ʊ�HClװ����ͬ��ʵ������������������������̼��װ��Ϊ��Һ������װ�ã���ѡC��
��2������ʳ��ˮ���Խ���������ˮ��Һ�е��ܽ�ȣ����ñ���ʳ��ʽ��ȥ�����е�HCl��
��3���������������Ʒ�Ӧ�����Ȼ��ơ����������ˮ����Ӧ����ʽΪ��
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O���������������ж�����̼��ˮ��Ӧ����̼��ơ�HClO��HClO�ڹ��������·ֽ�ΪHCl����������ط�Ӧ����ʽΪ��Ca(ClO)2 + 2CO2 + 2H2O=Ca(HCO3)2+ 2HClO ��2HClO![]() 2HCl+ O2����Ư�۱��ʣ�
2HCl+ O2����Ư�۱��ʣ�
��4���������֪��HCl��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ����Ӧ����ʽΪ��NaClO+2HCl=NaCl+Cl2��+H2O��
��5������Ӧ����Ԫ��ȫ������ԭ����Ԫ�ػ��ϼ���+7�۽���Ϊ+2�ۣ��ܹ�����5�ۣ���Ԫ�ػ��ϼ���HCl�е�-1����Ϊ�����е�0�ۣ��ܹ�����2�ۣ����ϼ�������С������Ϊ10���������ϵ��Ϊ2������ϵ��Ϊ5����ƽ��Ӧ����ʽΪ��2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O��
����Ӧ��ת�Ƶ�����ĿΪ10���õ����ű������ת��Ϊ![]() ����Ӧ��ClԪ�ػ��ϼ����ߣ�����������Ӧ�����������õ�HCl����KCl��MnCl2�����������õ�HClΪ6mol������1mol����ת��ʱ����������Ϊ0.5mol��������������ڱ����Ϊ0.5mol��22.4L/mol=11.2L��
����Ӧ��ClԪ�ػ��ϼ����ߣ�����������Ӧ�����������õ�HCl����KCl��MnCl2�����������õ�HClΪ6mol������1mol����ת��ʱ����������Ϊ0.5mol��������������ڱ����Ϊ0.5mol��22.4L/mol=11.2L��
��6���ô�װ��ģ�ҵ�ϳ����ᣬ����ȼ�չܿڴ���������������Ӧ����HCl��ͨ������C���п�ȼ�ԣ���CΪ��������ƿ�����ɵ�����Ϊ���������Ʊ������ķ�Ӧ����Ҫ���ȣ��������̺�Ũ����ķ�Ӧ����Ȳ��ܷ���Ũ�����������ڲ����ȵ������¿���������������d��ȷ�������ڴ�����������ȼ�������Ȼ��⣬������ɫ�Ļ��棬�Ȼ��⼫������ˮ���ڹܿ��Ϸ���ˮ������ϳ�����Һ�Σ���������������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����֪��CH3CH2CH2CH2OH��CH3CH2CH2CHO
������ͼװ�����������ϳ�����ȩ������������£�
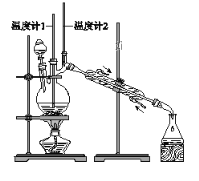
���� | �е�/�� | �ܶ�/(g��cm��3) | ˮ���ܽ��� |
������ | 117.2 | 0.8109 | �� |
����ȩ | 75.7 | 0.8017 | �� |
����˵���У�����ȷ���ǣ� ��
A. Ϊ��ֹ�����һ��������Ӧ���ữ��Na2Cr2O7��Һ��μ�����������
B. ���õĴ�����ȩ�м������������ƣ����������Ƿ���������
C. ��Ӧ������������ﵹ���Һ©���У���ȥˮ�㣬������ȩ�ӷ�Һ©���Ͽڵ���
D. ���¶ȼ�1ʾ��Ϊ90��95�棬�¶ȼ�2ʾ����76������ʱ���ռ�����