题目内容
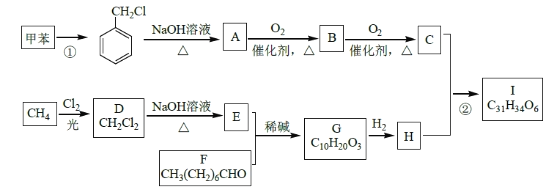
【题目】(NH4)3Fe(C6H5O7)2(柠檬酸铁铵)广泛用于医学、食品业等。实验室由硫酸亚铁和柠檬酸(  )等为原料制备柠檬酸铁铵产品的主要实验流程如图:
)等为原料制备柠檬酸铁铵产品的主要实验流程如图:
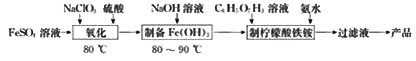
回答下列问题:
(1)“氧化”时,发生反应的离子方程式为________(ClO3-转化为Cl-)。
(2)氧化后的溶液¨制备Fe(OH)3”的详细实验操作为:在不断搅拌下,向氧化后的溶液中________。
(3)“制备柠檬酸铁铵”的装置(夹持及加热装置已略)如图所示

①图中仪器W的名称是________。
②Fe(OH)3与柠檬酸反应时温度需控制在65℃,适宜的加热方法是________;待Fe(OH)3完全溶解后,需将温度降到40℃后再滴加氨水,釆用较低温度滴加氨水,其原因是________ 。
③合适的尾气吸收装置是________(填字母)。
(4)由“过滤液”得到产品还需经过的操作是蒸发浓缩、冷却结晶、________、干燥。
【答案】6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 滴加NaOH溶液至沉淀不再增加,静置、过滤、洗净沉淀 (球形)冷凝管 热水浴 减少氨水中氨的挥发 C 过滤、洗涤
【解析】
(1)“氧化”时,ClO3-将溶液中的Fe2+氧化成Fe3+, 自身还原为Cl-, 根据得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(2)制备Fe(OH)3, 需向铁盐溶液中加入NaOH溶液;
(3)①根据图示仪器确定其名称;
②低于100℃的加热,用水浴加热;温度过高,会使得氨水中的NH3逸出;
③尾气吸收过程中应注意防止倒吸;
(4)结晶后需过滤、洗涤、干燥。
(1)“氧化”时,ClO3-将溶液中的Fe2+氧化成Fe3+, 自身还原为Cl-;反应过程中,Fe由+2价变为+3价,失去1个电子,Cl由+5价变为-1价,得到6个电子,根据得失电子守恒可得,Fe2+、Fe3+的系数为6,ClO3-、Cl-的系数为1;由电荷守恒可得,反应中含有H+, 且其系数为6;由氢原子守恒可得,生成物中有H2O,且其系数为3;因此可得该反应的离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(2)氧化后的溶液中含有Fe3+, 制备Fe(OH)3时,需向溶液中加入NaOH溶液至不再产生沉淀,静置后过滤,将固体洗净、干燥,即可得到Fe(OH)3;
(3)①图示仪器W为球形冷凝管;
②反应温度低于100℃,应采用热水浴方式进行加热;滴加氨水的过程中,由于温度过高,NH3容易逸出,为增大氨水的利用率,应在较低温度下滴加氨水;
③尾气吸收过程中,应注意防倒吸,图示烧杯C中倒置的漏斗可以起到防倒吸作用;
(4)结晶得到固体后,需经过滤、洗涤、干燥,才能得到产品。

【题目】用浓盐酸和二氧化锰制氯气的实验装置如图所示:

(1)下列气体实验室制备时,可以用相同发生装置的是 _______
A.O2 B. H2 C.HCl D. CO2
(2)制得的氯气中还含有氯化氢杂质,可通过装有______的洗气瓶除去。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________;漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的反应方程式____。
(4)据报道,日常生活中,将洁厕液(主要成分是HCl)与84消毒液(主要成分是次氯酸钠)混合使用会发生中毒的事故,生成有毒的氯气。写出反应的化学方程式______。
(5)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气。用浓盐酸和高锰酸钾制氯气的反应方程式如下: KMnO4 + HCl= KCl + MnCl2 + Cl2↑+ H2O
①配平该反应的化学方程式______。
②用“单线桥”在上述方程式上标出电子转移的方向和数目______。该反应中______元素被氧化,起酸性作用的HCl是______mol。当有1mol电子转移时,可生成气体(标准状态下)______ 升。
(6)(如图)有人做了一个改进实验。挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可以看到明显的燃烧现象(金属网用以防止气体混合爆炸)。

①用此装置模拟工业合成盐酸。则相应试剂选择正确的是_________(选填序号)。
溶液A | 固体B | 气体C | |
a | 稀硫酸 | Zn | Cl2 |
b | 浓盐酸 | MnO2 | H2 |
c | 稀硝酸 | Fe | Cl2 |
d | 浓盐酸 | KMnO4 | H2 |
②管口可观察到的现象是__________。