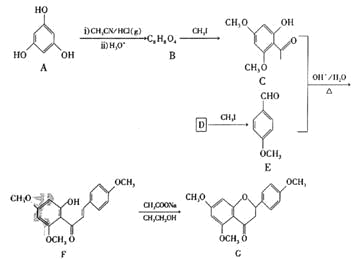
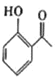
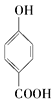
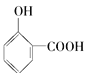
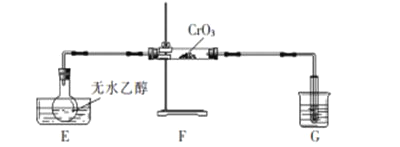
题目内容
【题目】将22克NaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55克,求原混合物中NaCl的物质的量浓度______。
【答案】2mol/L
【解析】
向含有NaCl和NaBr的溶液中加入足量的Cl2,发生反应Cl2+2NaBr=2NaCl+Br2,最后蒸干得到的固体为氯化钠。
反应前后固体质量减少了(22-17.55)g=4.45g,设反应的氯气为xmol,NaBr的物质的量为ymol,则: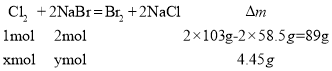
可得,![]() ,解得:x=0.05,y=0.1;
,解得:x=0.05,y=0.1;
因此混合物中溴化钠的质量为:![]() ,则氯化钠的质量为:
,则氯化钠的质量为:![]() ,所以氯化钠的物质的量为:n(NaCl)=
,所以氯化钠的物质的量为:n(NaCl)=![]() ,原混合物中NaCl的物质的量的浓度为
,原混合物中NaCl的物质的量的浓度为![]() 。
。

 名校课堂系列答案
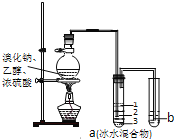
名校课堂系列答案【题目】用浓盐酸和二氧化锰制氯气的实验装置如图所示:

(1)下列气体实验室制备时,可以用相同发生装置的是 _______
A.O2 B. H2 C.HCl D. CO2
(2)制得的氯气中还含有氯化氢杂质,可通过装有______的洗气瓶除去。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________;漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的反应方程式____。
(4)据报道,日常生活中,将洁厕液(主要成分是HCl)与84消毒液(主要成分是次氯酸钠)混合使用会发生中毒的事故,生成有毒的氯气。写出反应的化学方程式______。
(5)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气。用浓盐酸和高锰酸钾制氯气的反应方程式如下: KMnO4 + HCl= KCl + MnCl2 + Cl2↑+ H2O
①配平该反应的化学方程式______。
②用“单线桥”在上述方程式上标出电子转移的方向和数目______。该反应中______元素被氧化,起酸性作用的HCl是______mol。当有1mol电子转移时,可生成气体(标准状态下)______ 升。
(6)(如图)有人做了一个改进实验。挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可以看到明显的燃烧现象(金属网用以防止气体混合爆炸)。

①用此装置模拟工业合成盐酸。则相应试剂选择正确的是_________(选填序号)。
溶液A | 固体B | 气体C | |
a | 稀硫酸 | Zn | Cl2 |
b | 浓盐酸 | MnO2 | H2 |
c | 稀硝酸 | Fe | Cl2 |
d | 浓盐酸 | KMnO4 | H2 |
②管口可观察到的现象是__________。