题目内容
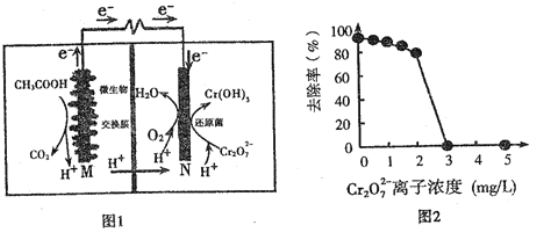
【题目】锌铁氧化还原液流电池工作原理如图所示

下列说法正确的是( )
A.膜X、膜Y分别是阴离子、阳离子交换膜
B.放电时,M极上的电势比N极上的高
C.放电时,负极电极反应式为:Zn+4OH--2e=Zn(OH)42-
D.充电时,阳极电极反应式为:Fe3++e-=Fe2+
【答案】C
【解析】
A.左侧电极中电解质溶液中含有Na+, 右侧电极中电解质溶液中含有Cl-, 因此放电过程中,Na+通过膜X移向右侧,Cl-通过膜Y移向左侧,充电时相反,因此膜X为阳离子交换膜,膜Y为阴离子交换膜,故A错误;
B.放电时,M电极为原电池的负极,N电极为原电池的阴极,因此M电极的电势比N电极低,故B错误;
C.放电时,M电极上Zn发生失电子的氧化反应,生成Zn(OH)42- 其电极反应式为: Zn+4OH--2e-=Zn(OH)42-, 故C正确;
D.充电时,右侧电解质溶液中的Fe2+发生失电子的氧化反应,生成Fe3+, 其电极反应式为Fe2+-e-=Fe3+,故D错误;
故答案为:C。

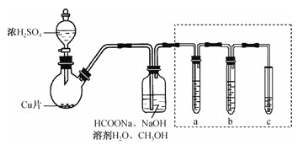
【题目】用浓盐酸和二氧化锰制氯气的实验装置如图所示:

(1)下列气体实验室制备时,可以用相同发生装置的是 _______
A.O2 B. H2 C.HCl D. CO2
(2)制得的氯气中还含有氯化氢杂质,可通过装有______的洗气瓶除去。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________;漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的反应方程式____。
(4)据报道,日常生活中,将洁厕液(主要成分是HCl)与84消毒液(主要成分是次氯酸钠)混合使用会发生中毒的事故,生成有毒的氯气。写出反应的化学方程式______。
(5)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气。用浓盐酸和高锰酸钾制氯气的反应方程式如下: KMnO4 + HCl= KCl + MnCl2 + Cl2↑+ H2O
①配平该反应的化学方程式______。
②用“单线桥”在上述方程式上标出电子转移的方向和数目______。该反应中______元素被氧化,起酸性作用的HCl是______mol。当有1mol电子转移时,可生成气体(标准状态下)______ 升。
(6)(如图)有人做了一个改进实验。挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可以看到明显的燃烧现象(金属网用以防止气体混合爆炸)。

①用此装置模拟工业合成盐酸。则相应试剂选择正确的是_________(选填序号)。
溶液A | 固体B | 气体C | |
a | 稀硫酸 | Zn | Cl2 |
b | 浓盐酸 | MnO2 | H2 |
c | 稀硝酸 | Fe | Cl2 |
d | 浓盐酸 | KMnO4 | H2 |
②管口可观察到的现象是__________。
【题目】重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++Cr2O72+H2O = 2BaCrO4↓+2H+、4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使Cr2O72完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol·L-1 NaOH标准溶液滴定至终点,重复上述操作3次。滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.05 | 21.06 |
2 | 25.00 | 1.98 | 21.97 |
3 | 25.00 | 0.20 | 21.98 |
该样品中氮的质量分数为_________(结果保留两位小数),并写出简要的运算过程。