题目内容
2.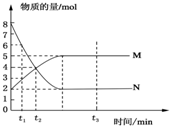 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )| A. | t2时刻M与N的物质的量浓度之比为1:1 | |
| B. | t2与t3时刻的混合气体的平均相对分子质量相等 | |
| C. | 反应物与生成物平衡时的物质的量浓度之比是2:5 | |
| D. | 0~t2内用M表示的平均反应速率是 1/t2mol/(L•min) |
分析 图象看出反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol-2mol=6mol,M的物质的量增多,应为是生成物,物质的量的变化值为5mol-2mol=3mol,则有n(N):n(M)=6mol:3mol=2:1,可知反应的化学方程式为2N?M,结合反应的方程式可计算相关物质的反应速率以及物质的量浓度关系.
解答 解:由图象可知反应的化学方程式为2N?M,
A.t2时M与N的物质的量相等,则浓度相等,浓度之比为1:1,故A正确;
B.t2与t3时刻的混合气体的总物质的量不同,分别为8mol和7mol,则平均相对分子质量不等,故B错误;
C.反应物与生成物平衡时的物质的量分别为2mol、5mol,则平衡时的物质的量浓度之比是2:5,故C正确;
D.0~t2内用M表示的平均反应速率是$\frac{\frac{4mol-2mol}{2L}}{{t}_{2}min}$=$\frac{1}{{t}_{2}}$mol/(L•min),故D正确.
故选B.
点评 本题考查化学反应速率的影响因素以及平衡图象题目,题目难度不大,注意把握图象中曲线的变化特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A. | 11和16 | B. | 6和8 | C. | 12和17 | D. | 19和9 |
13.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | L2+与R2-的核外电子数相等 |
10.A、B、C、D、E是短周期主族元素,其原子序数依次增大.A元素的气态氢化物可以与A元素的最高价氧化物对应的水化物反应生成盐,B元素原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,B和E处于同一族,B、E元素原子的核外电子数之和与C、D元素原子的核外电子数之和相等.下列说法不正确的是( )
| A. | B、C、D、E四种元素原子半径由大到小的顺序是:C>E>D>B | |
| B. | C和D两元素的最高价氧化物对应水化物的碱性:C>D | |
| C. | B和E两元素的气态氢化物热稳定性:B>E | |
| D. | A元素的气态氢化物与其最高价氧化物对应的水化物反应后产物中既含有离子键又含有共价键 |
17.X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | 1mol W的单质参加氧化还原反应时转移的电子数为2mol | |
| B. | X与W形成XW4时,各原子最外层均满足8电子稳定结构 | |
| C. | 0.3mol Cu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体 | |
| D. | Y的氢化物与W的氢化物反应的产物只含有共价键 |
7.下述情况下物质的量可能不相等的是( )
| A. | 密度相等,等体积的NO和 C2H6 (g) | B. | 常温常压下,等体积的NO和 C2H6 (g) | ||
| C. | 等温条件下,等体积的NO和 C2H6 (g) | D. | 常温常压下,等质量的NO和 C2H6 (g) |
3.下列表述正确的是( )
| A. | 2-丁烯的结构式CH3CH=CHCH3 | B. | 聚丙烯的结构简式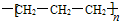 | ||
| C. | 四氯化碳分子的电子式 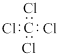 | D. | 丙烷分子的球棍模型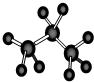 |
4.下列反应中属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2═CH2+HCl→CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. |  +HO-NO2$→_{60℃}^{浓硫酸}$ +HO-NO2$→_{60℃}^{浓硫酸}$ +H2O +H2O |
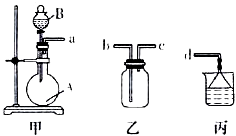 熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题:
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求.试回答以下问题: