题目内容
17.X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | 1mol W的单质参加氧化还原反应时转移的电子数为2mol | |
| B. | X与W形成XW4时,各原子最外层均满足8电子稳定结构 | |
| C. | 0.3mol Cu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体 | |
| D. | Y的氢化物与W的氢化物反应的产物只含有共价键 |
分析 X、Y、Z、W为四种短周期元素,主族元素其最高正化合价与其族序数相等,所以X位于第IVA族、Y位于第VA族,其最低负化合价=其族序数-8,所以Z位于第VIA族、W位于第VIIA族,原子的电子层数越多,其原子半径越大,电子层数相等的原子,其原子半径随着原子序数的增大而减小,Z、W的半径大于X、Y的半径,则Z、W位于第三周期,X、Y位于第二周期,所以X、Y、Z、W分别是C、N、S、Cl元素,再结合题目分析解答.
解答 解:X、Y、Z、W为四种短周期元素,主族元素其最高正化合价与其族序数相等,所以X位于第IVA族、Y位于第VA族,其最低负化合价=其族序数-8,所以Z位于第VIA族、W位于第VIIA族,原子的电子层数越多,其原子半径越大,电子层数相等的原子,其原子半径随着原子序数的增大而减小,Z、W的半径大于X、Y的半径,则Z、W位于第三周期,X、Y位于第二周期,所以X、Y、Z、W分别是C、N、S、Cl元素,
A.1molCl2参加氧化还原反应时转移的电子数可能为1mol,如Cl2+2NaOH=NaCl+NaClO+H2O,故A错误;
B.在ABn型分子中,如果A的族序数+成键电子对数=8,则该反应中所有原子都达到8电子稳定结构,C与Cl形成CCl4时,C原子的族序数+成键电子对数=4+4=8,所以各原子最外层均满足8电子稳定结构,故B正确;
C.铜和稀硝酸反应生成NO,但和稀硫酸不反应,故C错误;
D.N的氢化物与Cl的氢化物反应的产物为氯化铵,氯化铵中存在离子键和共价键,故D错误;
故选B.
点评 本题考查了原子结构和元素性质,根据元素半径、元素化合价的元素周期律确定元素,再结合物质的性质、物质的结构分析解答,注意B中特殊情况,注意铵盐都可以离子键,为易错点.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
7.下列四个选项的描述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | CH3C(CH3)2CH2CH2CH(CH2CH3)CH3 的系统命名为:2,2,5-三甲基庚烷 | |
| C. | 羟基的电子式: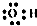 | |
| D. | CCl4的电子式: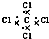 |
8.下列关于18O示踪原子的踪迹判断错误的是( )
| A. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2+8H2O | |
| B. | CH3COOH+H18OC2H5$→_{△}^{浓硫酸}$CH3CO18OC2H5+H2O | |
| C. | CH3CH218OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H218O | |
| D. | C6H518OH+NaOH→C6H518ONa+H2O |
5.下列物质的化学用语表达正确的是( )
| A. | F-的结构示意图: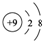 | |
| B. | 蓝矾的化学式:FeSO4•7H2O | |
| C. | 四氯化碳的电子式: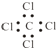 | |
| D. | 核内含有18个中子的氯原子:${\;}_{35}^{17}$Cl |
2.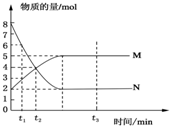 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )| A. | t2时刻M与N的物质的量浓度之比为1:1 | |
| B. | t2与t3时刻的混合气体的平均相对分子质量相等 | |
| C. | 反应物与生成物平衡时的物质的量浓度之比是2:5 | |
| D. | 0~t2内用M表示的平均反应速率是 1/t2mol/(L•min) |
9.对水煤气的转化反应:CO(g)+H2O(g)?CO2(g)+H2(g),下列叙述正确的是( )
| A. | 一定条件下,混合气体的平均相对分子质量不再改变,表明已达平衡状态 | |
| B. | 一定条件下,H2O的生成速率与CO的生成速率相等,表明已达到平衡状态 | |
| C. | 增加水蒸气浓度可提高CO的转化率 | |
| D. | 增加CO的浓度可提高CO的转化率 |
6.区别下列有关物质的描述不正确的是( )
| A. | 用氢氧化钠溶液区别乙醇溶液和葡萄糖溶液 | |
| B. | 用碳酸钠溶液区别乙酸和乙酸乙酯 | |
| C. | 用金属钠区别无水乙醇和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液区别甲烷和乙烯 |
19.下列化合物中的化学键中,只有离子键的是( )
| A. | H2O | B. | MgCl2 | C. | Na2SO4 | D. | NH4Cl |
 .
.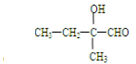 、
、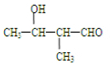 .
.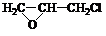 +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$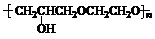 +nHCl
+nHCl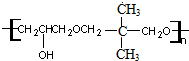 .
.