题目内容
10.A、B、C、D、E是短周期主族元素,其原子序数依次增大.A元素的气态氢化物可以与A元素的最高价氧化物对应的水化物反应生成盐,B元素原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,B和E处于同一族,B、E元素原子的核外电子数之和与C、D元素原子的核外电子数之和相等.下列说法不正确的是( )| A. | B、C、D、E四种元素原子半径由大到小的顺序是:C>E>D>B | |
| B. | C和D两元素的最高价氧化物对应水化物的碱性:C>D | |
| C. | B和E两元素的气态氢化物热稳定性:B>E | |
| D. | A元素的气态氢化物与其最高价氧化物对应的水化物反应后产物中既含有离子键又含有共价键 |
分析 A、B、C、D、E是短周期主族元素,其原子序数依次增大.A元素的气态氢化物可以与A元素的最高价氧化物对应的水化物反应生成盐,应为铵盐,则A为N元素;B元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;B和E处于同一族,则E为S元素;C、D、E处于同一周期,即处于第三周期,B、E元素原子的核外电子数之和与C、D元素原子的核外电子数之和相等,则C、D核外电子数之和为24,故C为Na、D为Al,据此解答.
解答 解:A、B、C、D、E是短周期主族元素,其原子序数依次增大.A元素的气态氢化物可以与A元素的最高价氧化物对应的水化物反应生成盐,应为铵盐,则A为N元素;B元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;B和E处于同一族,则E为S元素;C、D、E处于同一周期,即处于第三周期,B、E元素原子的核外电子数之和与C、D元素原子的核外电子数之和相等,则C、D核外电子数之和为24,故C为Na、D为Al.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:C(Na)>D(Al)>E(S)>B(O),故A错误;
B.非金属性Na>Al,故碱性:氢氧化钠>氢氧化铝,故B正确;
C.非金属性B(O)>E(S),氢化物稳定性与元素非金属性一种,故B元素气态氢化物更稳定,故C正确;
D.A元素的气态氢化物与其最高价氧化物对应的水化物反应后产物为硝酸铵,既含有离子键又含有共价键,故D正确,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
20.下列制品与材料类别不对应的是( )
| A. |  玻璃 无机非金属材料 | B. |  氧化硅陶 有机高分子材料 | ||
| C. |  不锈钢 金属材料 | D. |  玻璃钢 复合材料 |
1.A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中,正确的是( )
| A. | 烃A和B的实验式相同 | |
| B. | 烃A和B一定是同分异构体 | |
| C. | 烃A和B不可能是同系物 | |
| D. | 烃A和B各取1 mol,完全燃烧时生成CO2的质量一定相等 |
18. 设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
 设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )
设H+的质荷比为β,其有机物样品的质荷比如图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )| A. | 甲醇(CH3OH) | B. | 甲烷 | C. | 丙烷 | D. | 乙烯 |
5.下列物质的化学用语表达正确的是( )
| A. | F-的结构示意图: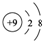 | |
| B. | 蓝矾的化学式:FeSO4•7H2O | |
| C. | 四氯化碳的电子式: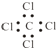 | |
| D. | 核内含有18个中子的氯原子:${\;}_{35}^{17}$Cl |
15.据美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,制得具有高熔点、高硬度的二氧化碳晶体.下列关于该晶体的说法正确的是( )
| A. | 该晶体属于分子晶体 | |
| B. | 该晶体易汽化,可用作制冷材料 | |
| C. | 一定条件下,该晶体可跟氢氧化钠反应 | |
| D. | 每摩尔该晶体中含5 mol C-O键 |
2.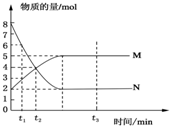 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
 在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为2L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )| A. | t2时刻M与N的物质的量浓度之比为1:1 | |
| B. | t2与t3时刻的混合气体的平均相对分子质量相等 | |
| C. | 反应物与生成物平衡时的物质的量浓度之比是2:5 | |
| D. | 0~t2内用M表示的平均反应速率是 1/t2mol/(L•min) |
19.下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
| A. | 食盐和蔗糖熔化 | B. | 乙醇和氯化氢溶于水 | ||
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
12.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
| 选项 | 物质 | 所含化学键类型 | 所属化合物类型 |
| A | MgCl2 | 离子键、非极性共价键 | 离子化合物 |
| B | CO2 | 极性共价键 | 共价化合物 |
| C | HCl | 离子键 | 离子化合物 |
| D | NaOH | 离子键、极性共价键 | 共价化合物 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |