��Ŀ����
����Ŀ����ѧ��Ӧԭ���ڻ���������ʵ�������Ź㷺����Ҫ��Ӧ�á�
��.���ú��̷�ˮ(��Ҫ��Mn2����SO![]() ��H����Fe2����Al3����Cu2��)���Ʊ������ܴ��Բ���̼����(MnCO3)������һ�ֹ����������£�
��H����Fe2����Al3����Cu2��)���Ʊ������ܴ��Բ���̼����(MnCO3)������һ�ֹ����������£�

��֪ijЩ������ȫ������pH���±���
������ | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
������ȫʱ��pH | 3.2 | 5.4 | 6.4 | 9.8 | ��0 | ��7 | ��7 |
�ش��������⣺
��1�����̢��У���������W����Ҫ�ɷ���______________________��
��2�����̢��У�������Ӧ�����ӷ���ʽ��______________________��
��3�����̢��У������ɵ�����J��ʹ����ʯ��ˮ����ǣ�������MnCO3�ķ�Ӧ�����ӷ���ʽ��_______________________��
��4����MnCO3���Ƶ���Ҫ�Ĵ���MnO2��2MnCO3��O2===2MnO2��2CO2�����ڿ����м���460.0 g MnCO3���õ�332.0 g��Ʒ������Ʒ������ֻ��MnO����ò�Ʒ��MnO2������������________(�ðٷ�����ʾ��С�������1λС��)��
��.�����£�Ũ�Ⱦ�Ϊ0.1 mol��L��1������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN/span> | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
��1����������Һ�е������ӣ����H��������ǿ����_______________________��
��2�����ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01 mol��L��1���������ʵ���Һ�У�������ǿ����________(�����)��
A. HCN�� B. HClO�� C. C6H5OH�� D. CH3COOH E. H2CO3
��.��֪:CO(g)+H2O(g)![]() CO2(g)+H2(g)����H = Q kJ��mol-1��ƽ�ⳣ�����¶ȱ仯���±���ʾ:
CO2(g)+H2(g)����H = Q kJ��mol-1��ƽ�ⳣ�����¶ȱ仯���±���ʾ:
�¶�/�� | 400 | 500 | 850 |
ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش���������:
��1��������Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ___,�÷�Ӧ��Q____(����>������<��)0��
��2��850 ��ʱ,�����Ϊ10 L�ķ�Ӧ����ͨ��һ������CO��H2O(g),����������Ӧ,CO��H2O(g)��Ũ�ȱ仯��ͼ��ʾ,��0~4 minʱƽ����Ӧ����v(CO)=____��
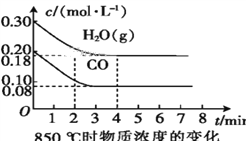
��3������500 ��ʱ����������Ӧ,��CO��H2O(g)����ʼŨ�Ⱦ�Ϊ0.020 mol��L-1,��������,CO�����ת����Ϊ____��
��4������850 ��ʱ����������Ӧ,����ʼʱCO��H2O(g)��Ϊ1 mol,����ˮ�������������Ϊx,ƽ��ʱCO��ת����Ϊy,���Ƶ�y��x�仯�Ĺ�ϵʽ:____��
���𰸡� Fe(OH)3��Al(OH)3 MnS��Cu2��===Mn2����CuS Mn2����2HCO===MnCO3����CO2����H2O 78.6% CO![]() D K=
D K=![]() < 0.03 mol��L-1��min-1 75% y=x
< 0.03 mol��L-1��min-1 75% y=x
����������.(1)���ݱ������ݿ�֪������������ɳ�����pHΪ5.2������������ȫ������pHΪ3.7�����Ե���pH��5.2��Fe2+��Al3+����Fe(OH)3��Al(OH)3����״̬���ڣ��������ijɷ�Ϊ��Fe(OH)3��Al(OH)3���ʴ�Ϊ��Fe(OH)3��Al(OH)3��
(2)CuS��pH��0ʱ��ȫ��������MnS��pH��7ʱ��ȫ���������Լ���MnS��Ϊ��ʹ����Cu2+����CuS������ȥ���ʽ���Ŀ����ʹMnS �� Cu2+���١���ַ�Ӧ����Ӧ�����ӷ���ʽ��MnS+Cu2+=Mn2++CuS�����ʴ�Ϊ��MnS+Cu2+=Mn2++CuS����
(3)���ɵ�����J��ʹ����ʯ��ˮ����ǣ�������Ϊ������̼��Mn2+�ͼ����HCO3-��Ӧ������CO2�����MnCO3��������Ӧ�����ӷ���ʽ��Mn2++2HCO3-=MnCO3+CO2��+H2O���ʴ�Ϊ��Mn2++2HCO3-=MnCO3+CO2��+H2O��
(4)MnCO3���ȷֽ�ΪMnO��MnO��������ΪMnO2����Ʒ��������MnO��460.0 gMnCO3�����ʵ���Ϊ��![]() =4mol�����Ȳ���4molMnO�������MnO2���ʵ���Ϊxmol������xmolMnO������ʣ��MnOΪ(4-x)mol�������������Ϊ��(4-x)mol��71g/mol+xmol��87g/mol=332g�����x=3����MnO2����������=
=4mol�����Ȳ���4molMnO�������MnO2���ʵ���Ϊxmol������xmolMnO������ʣ��MnOΪ(4-x)mol�������������Ϊ��(4-x)mol��71g/mol+xmol��87g/mol=332g�����x=3����MnO2����������=![]() ��100%=78.6%���ʴ�Ϊ��78.6%��
��100%=78.6%���ʴ�Ϊ��78.6%��
��.(1)��ĵ���ƽ�ⳣ��ԽС������ĵ���̶�ԽС���������ˮ��̶�Խ����ͬŨ�ȵ�������Һ��pHԽ�������������Խ������Һ��PH֪��������ǿ�����Ǵ��ᣬ����������̼��������ӣ���������������������CO32-���ʴ�Ϊ��CO32-��
(2)��ĵ���ƽ�ⳣ��Խ����ĵ���̶�Խ�����������Խǿ���������ˮ��̶�ԽС����ͬŨ�ȵ�������Һ��pHԽС������������ǿ���Ǵ���ʴ�Ϊ��D��
��.(1)CO(g)+H2O(g)CO2(g)+H2(g)��ƽ�ⳣ��ΪK=![]() ���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ������Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ������H=Q��0���ʴ�Ϊ��
���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ������Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ������H=Q��0���ʴ�Ϊ��![]() ������
������
(2)v(CO)=![]() =0.03mol/(Lmin)���ʴ�Ϊ��0.03mol/(Lmin)��
=0.03mol/(Lmin)���ʴ�Ϊ��0.03mol/(Lmin)��
(3)����ƽ��ʱCO�� ת���������CO��Ũ�ȱ仯��Ϊc����
CO(g)+H2O(g)H2(g)+CO2(g)
��ʼ(mol/L)��0.02 0.02 0 0
ת��(mol/L)�� c c c c
ƽ��(mol/L)��0.02-c 0.02-c c c
500��ʱ��Ӧƽ�ⳣ��K=![]() =9�����c=0.015��CO���������ת����Ϊ��
=9�����c=0.015��CO���������ת����Ϊ��![]() ��100%=75%���ʴ�Ϊ��75%��
��100%=75%���ʴ�Ϊ��75%��
(4)800��ʱ��Ӧƽ�ⳣ��Ϊ1����ʼʱˮ�����ʵ���Ϊxmol��CO�����ʵ���Ϊ (1-x)mol��ƽ��ʱCO��ת����Ϊy����ת����COΪ(1-x)y mol����
CO(g) + H2O(g)H2(g)+CO2(g)
��ʼ(mol)�� 1-x x 0 0
ת��(mol)�� (1-x)y (1-x)y (1-x)y (1-x)y
ƽ��(mol)��(1-x)(1-y) (x-y+xy) (1-x)y (1-x)y
����ƽ�ⳣ��K=![]() =1��������x=y���ʴ�Ϊ��x=y��
=1��������x=y���ʴ�Ϊ��x=y��