题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B. 某密闭容器盛0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
C. 1 mol Na与足量O2在一定条件下完全反应时转移电子数为NA
D. 1 mol·L-1Na2SO4溶液中,Na+和SO![]() 离子数的总和一定为3NA
离子数的总和一定为3NA
【答案】C
【解析】标准状况下,HF是液体,所以选项A错误。N2和H2的反应是可逆反应,所以0.1mol的N2不可能完全参与反应,所以转移电子一定小于0.6mol,选项B错误。Na与足量O2在一定条件下完全反应,Na一定转化为Na+,所以1molNa一定转移1mol电子,选项C正确。选项D中未说明溶液体积,所以无法计算,选项D错误。

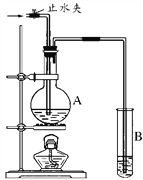
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。