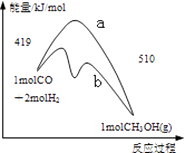
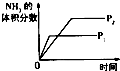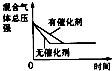ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩάϊ”ΟΖœΦν‘ϋ(÷ς“Σ≥…Ζ÷ΈΣNa2CO3)¥ΠάμΝρΥα≥ßΈ≤Τχ÷–ΒΡSO2Θ§Ω…÷ΤΒΟΈόΥ°Na2SO3(≥…ΤΖΘ©Θ§ΤδΝς≥Χ»γΆΦΥυ ΨΓΘ
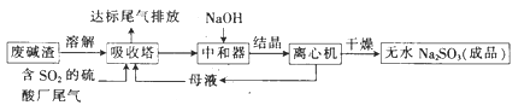
(1)Ρ≥ΝρΥα≥ß≈≈Ζ≈≥ωΒΡΈ≤Τχ÷–SO2ΒΡΚ§ΝΩΧΊ±πσ{Θ§ΕχΖœΦν‘ϋΒΡΝΩ≤ΜΉψΘ§¥Υ ±ΓΑΈϋ ’ΥΰΓ±ΡΎΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______________(≤ΜΩΦ¬«H2O”κSO2Ζ¥”Π)ΓΘ
(2)―«ΝρΥαΡΤΒΡ»ήΫβΕ»«ζœΏ»γΆΦΥυ ΨΘ§‘ρ…œ ωΝς≥Χ÷–ΓΑΫαΨßΓ±ΒΡΖΫΖ® «___________(ΧνΓΑ’τΖΔΫαΨßΓ±ΜρΓΑΫΒΈ¬ΫαΨßΓ±)Θ§ΆΦ÷–aΒψΥυ ΨΖ÷…ΔœΒάύ±πΈΣ____________(ΧνΓΑΉ«“ΚΓ±ΓΑΫΚΧεΓ±ΜρΓΑ»ή“ΚΓ±Θ©ΓΘ
(3)Ϋω”ΟBaCl2ΓΔH2O2ΚΆΙΐΝΩœΓ―ΈΥαΒΡΜλΚœ»ή“ΚΡ―“‘Φλ≥ωΓΑ≥…ΤΖΓ±÷–ΒΡSO32-Θ§‘≠“ρ «ΓΑ≥…ΤΖΓ±÷–Κ§”–Ρ≥÷÷‘”÷ “θάκΉ”ΓΘ
ΔΌΗΟ‘”÷ “θάκΉ”ΈΣ________________(ΧνάκΉ”ΖϊΚ≈Θ©ΓΘ
ΔΎ25Γφ ±Θ§≤ΩΖ÷±Β―ΈΒΡKsp»γœ¬±μΥυ ΨΓΘ
Μ·―ß Ϋ | BaSO4 | BaSO3 |
Ksp | 1.1ΓΝ10-10 | 5.5ΓΝ10-7 |
ΫΪΒΟΒΫΒΡΓΑ≥…ΤΖΓ±»ή”ΎΥ°Θ§≤βΒΟ»ή“Κ÷–SO32-ΒΡ≈®Ε»ΈΣ0.5mol L-1Θ§ΈΣ‘”÷ “θάκΉ”≈®Ε»ΒΡ10±ΕΘ§œρΗΟ»ή“Κ÷–Φ”»κΒ»ΧεΜΐΓΔ0.5molΓΛL-1ΒΡBaCl2»ή“ΚΘ§≥δΖ÷Ζ¥”ΠΚσc(Ba2+)=_______mol L-1ΓΘΘ®ΜλΚœ ±»ή“ΚΧεΜΐΒΡ±δΜ·Κω¬‘≤ΜΦΤΘ©
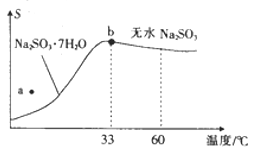
(4)Ρ≥Ά§―ß≤…”Ο»γœ¬ΖΫΖ®Φλ―ιSO32-ΘΚ
![]()
ΔΌœ¥Β” ± Ι”ΟΒΡ ‘ΦΝΉνΚΟΈΣ____________(ΧνΉ÷ΡΗ)ΓΘ
a.œΓHNO3 b.’τΝσΥ° c.œΓH2SO4
ΔΎΗυΨί…œ ωΝς≥Χ÷–ΒΡ ΐΨί(wΓΔxΓΔy)_____________ (ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±)ΦΤΥψ≥ω≥…ΤΖ ‘―υ÷–SO32-ΒΡΑΌΖ÷Κ§ΝΩΘ§»τΡήΘ§‘ρSO32-ΒΡΑΌΖ÷Κ§ΝΩΈΣ (»τ≤ΜΡήΘ§‘ρ¥ΥΩ’≤ΜΧν)ΘΜ»τ≤ΜΡήΘ§‘ράμ”… «_____________(»τΡήΘ§‘ρ¥ΥΩ’≤ΜΧνΘ©ΓΘ
ΓΨ¥πΑΗΓΩ CO32-+2SO2+H2O=CO2+2HSO3- ’τΖΔΫαΨß Ή«“Κ SO42- 2.2ΓΝ10-5 b ≤ΜΡή ΑΉ…Ϊ≥ΝΒμB”κ…ΌΝΩ―ΈΥαΖ¥”Π ±Θ§BaSO3ΟΜ”–»Ϊ≤Ω»ήΫβ
ΓΨΫβΈωΓΩ±ΨΧβ÷ς“ΣΩΦ≤ιΝρΒΡΜ·ΚœΈο―«ΝρΥαΡΤΒ»Έο÷ ΒΡ–‘÷ ΓΘ
(1)Ρ≥ΝρΥα≥ß≈≈Ζ≈≥ωΒΡΈ≤Τχ÷–SO2ΒΡΚ§ΝΩΧΊ±πσ{Θ§ΕχΖœΦν‘ϋΒΡΝΩ≤ΜΉψΘ§¥Υ ±ΓΑΈϋ ’ΥΰΓ±ΡΎΖΔ…ζΖ¥”Π…ζ≥…―«ΝρΥα«βΡΤΚΆΕΰ―θΜ·ΧΦΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣCO32-+2SO2+H2O=CO2+2HSO3-ΓΘ
(2)…œ ωΝς≥Χ÷–ΓΑΫαΨßΓ±ΒΟΒΫΈόΥ°Na2SO3Θ§ΈόΥ°Na2SO3ΒΡ»ήΫβΕ»ΥφΈ¬Ε»…ΐΗΏ±δΜ·ΜΚ¬ΐΘ§Υυ“‘ΓΑΫαΨßΓ±ΒΡΖΫΖ® «’τΖΔΫαΨßΘ§ΆΦ÷–aΒψ±ΞΚΆ»ή“Κ÷–Κ§”–ΨßΧεΘ§Υυ“‘ΆΦ÷–aΒψΥυ ΨΖ÷…ΔœΒάύ±πΈΣΉ«“ΚΓΘ
(3)ΔΌΗΟ‘”÷ “θάκΉ”ΈΣΩ…“‘Ά®ΙΐH2O2”κSO32-Ζ¥”Π…ζ≥…ΒΡSO42-ΓΘ
ΔΎ¥”±Β―ΈΒΡKspΚΆ»ή“Κ÷–SO32-ΒΡ≈®Ε»ΈΣSO42-ΒΡ10±Ε≈–ΕœΘ§œ»…ζ≥…ΝρΥα±Β≥ΝΒμΘ§Κσ…ζ≥…―«ΝρΥα±Β≥ΝΒμΓΘ Θ”ύSO32-ΒΡ≈®Ε»ΈΣ0.025mol L-1Θ§c(Ba2+)=Ksp(BaSO3)/ Θ”ύSO32-ΒΡ≈®Ε»=2.2ΓΝ10-5mol L-1ΓΘ
(4)ΔΌa.œΓHNO3Ω…ΫΪBaSO3―θΜ·ΈΣBaSO4ΘΜb.’τΝσΥ°Ω…œ¥»Ξ‘”÷ άκΉ”ΘΜc.œΓH2SO4Ω…ΫΪΙΐΝΩ≤ΩΖ÷BaCl2ΉΣΜ·ΈΣBaSO4ΓΘΙ ―ΓbΓΘ
ΔΎΗυΨί…œ ωΝς≥Χ÷–ΒΡ ΐΨί(wΓΔxΓΔy)≤ΜΡήΦΤΥψ≥ω≥…ΤΖ ‘―υ÷–SO32-ΒΡΑΌΖ÷Κ§ΝΩΘ§άμ”… «ΑΉ…Ϊ≥ΝΒμB”κ…ΌΝΩ―ΈΥαΖ¥”Π ±Θ§BaSO3ΟΜ”–»Ϊ≤Ω»ήΫβΓΘ

 Οϊ ΠΒψ≤ΠΨμœΒΝ–¥πΑΗ
Οϊ ΠΒψ≤ΠΨμœΒΝ–¥πΑΗΓΨΧβΡΩΓΩœ¬Ν–Έο÷ ΒΡΟη ωΚΆœύΙΊ÷Σ ΕΨυ’ΐ»ΖΒΡ «
Έο÷ ΦΑ±δΜ· | Οη ω | œύΙΊ÷Σ Ε | |
A | ΒβΜ·ΦΊ»ή“ΚΒΈΒΫΆΝΕΙΤ§…œ | ±δάΕ…Ϊ | ΆΝΕΙΤ§Κ§ΒμΖέ |
B | ΟΚΒΡΤχΜ· | Μ·―ß±δΜ· | ÷ς“ΣΖ¥”Π «ΧΦ”κΥ°…ζ≥…Υ°ΟΚΤχΒ» |
C | ““œ©ΚΆ±Ϋ | ΕΦΡή ΙδεΥ°Ά …Ϊ | Ζ÷Ή”÷–Κ§”–œύΆ§ΒΡΧΦΧΦΥΪΦϋ |
D | ’αΧ«ΚΆ¬σ―ΩΧ« | ΕύΧ« | Εΰ’ΏΜΞΈΣΆ§Ζ÷“λΙΙΧε |
A. A B. B C. C D. D
ΓΨΧβΡΩΓΩΕ‘”ΎΩ…ΡφΖ¥”ΠN2Θ®gΘ©+3H2Θ®gΘ©2NH3Θ®gΘ©ΓςHΘΦ0Θ§œ¬Ν–―–ΨΩΡΩΒΡΚΆ Ψ“βΆΦœύΖϊΒΡ «Θ® Θ©
A | B | C | D | |
―–ΨΩΡΩΒΡ | ―Ι«ΩΕ‘Ζ¥”ΠΒΡ”ΑœλΘ®P2ΘΨP1Θ© | Έ¬Ε»Ε‘Ζ¥”ΠΒΡ”Αœλ | ΤΫΚβΧεœΒ‘ωΦ”N2Ε‘Ζ¥”ΠΒΡ”Αœλ | ¥ΏΜ·ΦΝΕ‘Ζ¥”ΠΒΡ”Αœλ |
ΆΦ Ψ |
|
|
|
|
A.A
B.B
C.C
D.D