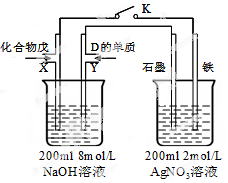
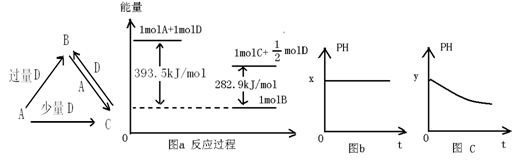
题目内容
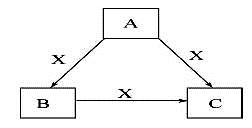
(10分)A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。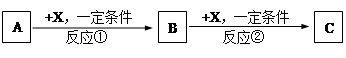
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属元素价态的操作方法是: 。则B的化学式为 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,B为两性化合物,则X的化学式可能为(写出不同类物质) 或 ,
反应①的离子方程式为(写一条) 。
(10分)
(1)d、e(2分)
(2)向溶液中滴加少量KSCN溶液,无明显现象,通入少量Cl2溶液呈血红色 (2分)
(3)HCl;NaOH(各1分) AlO2-+ H+ + H2O = Al(OH)3↓或Al3++3OH-= Al(OH)3↓(2分)
解析试题分析:由题可知,A与X反应可进行两个阶段,可知A与X中至少有一种元素具有两种不同的价态。
(1)由题,若X是强氧化性单质,则A被氧化,是还原剂,同时与X可生成两种不同价态的纯净物,由题可得S可生成多种价态,如SO2、SO3等符合条件;N可被氧化生成多种价态,如NO、NO2等,Na亦可被氧化生成多种价态的化合物,如Na2O2,Na2O等;Mg与Al均不可;
(2)由题向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,可知A为Cl,Cl与金属反应一般产生负一价,所以有变价的为X。常见的金属元素中有变价的有Fe、Cu、Mn等;
(3)由题可知B为两性化合物且X为强电解质,A与X反应生成B,B与X反应生成C,C与A反应生成B,所以B应为Al(OH)3,强电解质X既可能是酸(如HCl)也可能碱 (如NaOH)。若X为酸,如HCl时,反应①离子方程式 AlO2-+ H+ + H2O = Al(OH)3↓;若X为碱,如NaOH时,反应①离子方程式为Al3++3OH-= Al(OH)3↓。
考点:本题以框图为基础,考元素及化合物、氧化还原反应、离子的检测、两性化合物的性质。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案下列物质转化在给定条件下能实现的是
①FeS2 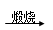 SO3
SO3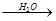 H2SO4
H2SO4 CO2
CO2
② Al2O3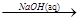 NaAlO2(aq)
NaAlO2(aq) Al(OH)3
Al(OH)3
③NaCl(aq) Na
Na NaOH(aq)
NaOH(aq)
④Fe FeSO4(aq)
FeSO4(aq) Fe(OH)2
Fe(OH)2 Fe2O3
Fe2O3
⑤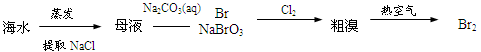
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
下列说法不正确的是
| A.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| B.浓硝酸在光照下发黄,说明浓硝酸不稳定 |
| C.SO2、NO2分别与水发生的反应均为氧化还原反应 |
| D.水泥、普通玻璃、陶瓷等都是传统的硅酸盐制品 |
下列说法正确的是
| A.电解、电镀、电化学腐蚀都需要通电才可进行 |
| B.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| C.浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 |
| D.从石油中得到汽油,可采用分馏的方法 |