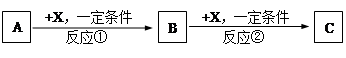题目内容
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
(1)①第三周期ⅢA族 抑制
②3[Al(OH)4]-+ Al3+=4Al(OH)3↓
(2)①6 
②Cl2+H2O= H++Cl-+ HClO
(3)①离子键、共价键
② C(CO32-)<C(H+)<C(OH-)<C(HCO3-)<C(Na+)
解析试题分析:(1)①若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有[Al(OH)4]?,x为氢氧化钠。所以A中含有的金属元素为Al,在元素周期表中的位置为:第三周期IIIA族;X为NaOH,强碱对抑制水的电离平衡。
②A中含Al3+、C中含[Al(OH)4]?,二者混合生成Al(OH)3,离子方程式为:3[Al(OH)4]-+ Al3+=4Al(OH)3↓
(2)①若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气。若A为该元素的白色固体单质,则A为白磷,白磷分子为正四面体构型,所以1mol A单质中含共价键数目为6NA ,B为三氯化磷,电子式为:
②X为氯气,与水反应的离子方程式为:Cl2+H2O= H++Cl-+ HClO
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,所以A中所含有的化学键是: 离子键、共价键。
②C为NaHCO3,HCO3?的水解程度大于电离程度,溶液呈碱性,所以NaHCO3溶液中离子浓度由小到大的顺序是:C(CO32-)<C(H+)<C(OH-)<C(HCO3-)<C(Na+)
考点:本题考查元素化合物推断、盐类的水解、方程式的书写、化学键与电子式、离子浓度比较。

将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如下图,符合图中情况的一组物质是( )。
| | A | B | C | D |
| X | H2S | HCl | NH3 | NH3·H2O |
| Y | Na2SO3 | NaAlO2 | AlCl3 | AgNO3 |
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 | Fe(OH)2 | Fe(OH)3 |
| Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
(1)D原子结构示意图为_____________。
(2)将C的低价态氧化物甲通入到D单质的水溶液会使之褪色,体现了甲的________性,写出该反应的离子方程式_____________________。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100 mL 8.0 mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是_______________,还原剂失电子数为_________________。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为____________________,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为___________________________________________________;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式____________________________________________________________。