题目内容
5.下列对事实的解释或结论不正确的是( )| 事实 | 解释或结论 | |
| A | 向Na2CO3浓溶液中通入足量CO2溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| B | 常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH | 酸性:H2CO3<H2SO3 |
| C | 向2mL 1mol/LAlCl3溶液中加入几滴1mol/LNaOH溶液,生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色 | Ksp:Al(OH)3>Fe(OH)3 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.相同条件下,碳酸氢钠的溶解度比碳酸钠的溶解度小;
B.相同浓度NaHCO3溶液的pH大于NaHSO3的pH,pH大的对应酸的酸性越弱;
C.NaOH不足,生成氢氧化铝沉淀,然后发生沉淀的转化;
D.酸性条件下硝酸根离子的氧化性大于过氧化氢的氧化性.
解答 解:A.向Na2CO3浓溶液中通入足量CO2溶液变浑浊生成碳酸氢钠,可知溶解度:NaHCO3<Na2CO3,故A正确;
B.常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH,前者pH大,可知酸性:H2CO3<H2SO3,故B正确;
C.生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色,发生沉淀的转化,氢氧化铁更难溶,则 Ksp:Al(OH)3>Fe(OH)3,故C正确;
D.将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色,亚铁离子被氧化,但硝酸根离子可氧化亚铁离子,不能比较H2O2、Fe3+的氧化性,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、酸性比较与盐类水解、沉淀转化、氧化还原反应等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
13.下列化合物中,既有离子键,又有共价键的是( )
| A. | NH3 | B. | KOH | C. | CaCl2 | D. | H2O |
14.分子式为C4H10O并能与钠反应放出氢气的有机物同分异构体有x种(不包括立体异构,下同),分子式为C5H10O2并能与NaHCO3溶液反应放出CO2的有机物的同分异构体有y种,则x和y的关系为( )
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
13.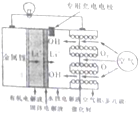 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
20.下列说法正确的是( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热都是反应热的种类之一 | |
| D. | 其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等 |
17.利用实验装置进行相关操作,不能达到相应实验目的是( )
| 序号 | 实验装置 | 实验目的 |
| A | 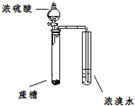 | 证明浓硫酸具有脱水性、氧化性 |
| B | 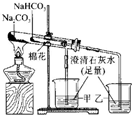 | 比较碳酸钠与碳酸氢钠固体的热稳定性 |
C | 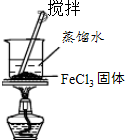 | 制取少量的Fe(OH)3胶体 |
| D | 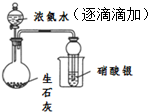 | 证明浓氨水与生石灰作用可制备得到氨气 |
| A. | A | B. | B | C. | C | D. | D |
14.已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L-1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是( )
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
15.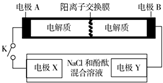 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | K+从右到左通过离子交换膜 | |
| B. | A的电极反应式为:3I--2e-=I3- | |
| C. | 当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) | |
| D. | 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
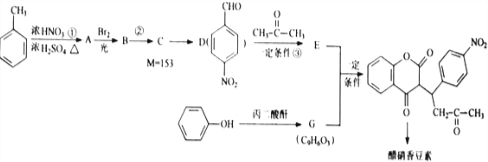
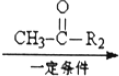 R1-CH=
R1-CH=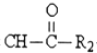 +H2O
+H2O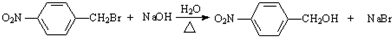 .
. .
.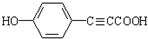 .
.