题目内容
1.能源短缺是人类面临的重大问题.一种可再生能源甲醇,具有广泛的开发和应用前景,被称为21世纪的新型燃料.工业上用 CO 生产燃料甲醇,一定条件下发生:CO(g)+2H2(g)═CH3OH(g)图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入 4mol H2 和一定量的 CO 后,CO和 CH3OH(g)的浓度随时间变化图.
请回答下列问题:
(1)在“图1”中,曲线b改变的条件最可能是使用了催化剂.
(2)根据“图2”判断,下列说法不正确的是C
A.容器中压强恒定时,反应已达平衡状态
B.起始充入的CO为2mol
C.增加CO浓度,CO的转化率增大
D.保持温度和密闭容器容积不变,再充入1molCO和 2molH2,再次达到平衡时$\frac{n(C{H}_{3}OH)}{c(CO)}$会增大
(3)若升高温度,保持其它条件不变,则该反应的化学平衡将左(填“左”、“右”或“不”)移动.
(4)科学家常用量热计(填仪器名称)来直接测定某一反应的反应热.现测得:某温度时:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-385.8kJ/mol,
又知 H2O(l)=H2O(g)△H=+44kJ/mol,请写出表示 CH3OH 燃烧热的热化学方程式:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.
分析 (1)加入催化剂,可降低反应的活化能;
(2)A.容器中压强恒定时,说明气体物质的量相等,反应已达平衡状态;
B.CO的起始浓度为1moL/L,体积为2L,则起始充入的CO为2mol;
C.增加CO浓度,平衡正向移动,氢气的转化率变大,而CO的转化率减小;
D.保持温度和密闭容器容积不变,再充入1molCO和 2molH2,相当于给体系增大压强,平衡正向移动,所以再次达到平衡时$\frac{n(C{H}_{3}OH)}{c(CO)}$会增大;
(3)由图1可知,反应物的总能量大于生成物的总能量,则反应为放热反应,所以升高温度平衡向吸热反应方向移动;
(4)常用量热计来直接测定某一反应的反应热;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-385.8kJ/mol ①,
H2O(l)=H2O(g)△H=+44kJ/mol②,
将方程式$\frac{1}{2}$①-2②得甲醇燃烧热化学方程式.
解答 解:(1)由图象可知b活化能较低,应加入催化剂,故答案为:使用了催化剂;
(2)A.容器中压强恒定时,说明气体物质的量相等,反应已达平衡状态,故正确;
B.CO的起始浓度为1moL/L,体积为2L,则起始充入的CO为2mol,故正确;
C.增加CO浓度,平衡正向移动,氢气的转化率变大,而CO的转化率减小,故错误;
D.保持温度和密闭容器容积不变,再充入1molCO和 2molH2,相当于给体系增大压强,平衡正向移动,所以再次达到平衡时$\frac{n(C{H}_{3}OH)}{c(CO)}$会增大,故正确;
故选:C;
(3)由图1可知,反应物的总能量大于生成物的总能量,则反应为放热反应,所以升高温度平衡逆向移动,故答案为:左;
(4)常用量热计来直接测定某一反应的反应热;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-385.8kJ/mol ①,
H2O(l)=H2O(g)△H=+44kJ/mol②,
将方程式$\frac{1}{2}$①-2②得甲醇燃烧热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol,
故答案为:量热计;CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.
点评 本题考查盖斯定律、平衡移动方向判断、反应速率计算等知识点,侧重考查学生分析计算能力,为高频考点,注意:增加可逆反应中某一反应物浓度,平衡正向移动但该物质的转化率反而降低,为易错点.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 两种溶液中OH-浓度相同 | |
| B. | 需要等浓度、等体积的盐酸中和 | |
| C. | 温度升高10℃,两溶液的pH仍相等 | |
| D. | 两种溶液中溶质的物质的量浓度相同 |
| A. | Fe2O3 | B. | Na | C. | BaSO4 | D. | Na2O |
| A. | N4属于一种新型的化合物 | |
| B. | 等质量的N4与N2所含的原子个数比为2:1 | |
| C. | N4与N2的摩尔质量相等 | |
| D. | 等质量的N4与N2所含的原子个数比为1:1 |
| A. | 虽然石墨有较好的导电性,但它不属于电解质 | |
| B. | CaCO3、BaSO4都难溶于水,但它们都是电解质 | |
| C. | 酒精(纯净物)在水溶液和熔融状态下均不能导电,所以酒精属于非电解质 | |
| D. | 实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 |
物质 组别 | 甲 | 乙 | 丙 |
| A | Cl2 | MgBr2 | NaOH |
| B | SO2 | Ca(OH)2 | NaHCO3 |
| C | SiO2 | NaOH | HF |
| D | NH3 | O2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
 (1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1.
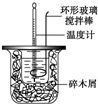
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1.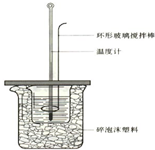 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题: