题目内容
【题目】如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。

现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(1)用量筒量取该浓硫酸____________mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是____。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是__________。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,仰视容量瓶刻度线
(4)某同学用固体Na2CO3配制500 mlL 0.1molL-1溶液的过程如图所示:

你认为该同学的错误步骤有__________处。
【答案】13.6 250mL容量瓶和胶头滴管 BC 2
【解析】
(1)由标签数据,利用公式c=![]() 计算出浓硫酸的浓度,欲配制220mL的溶液,需选用250mL容量瓶;再根据稀释定律计算出需要的浓硫酸的体积;
计算出浓硫酸的浓度,欲配制220mL的溶液,需选用250mL容量瓶;再根据稀释定律计算出需要的浓硫酸的体积;
(2)配制溶液时需要量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管;
(3)A.用量筒量取浓硫酸时俯视,导致量取的浓硫酸的体积偏小;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,冷却后溶液的体积缩小;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,溶质的物质的量增大;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,加入的溶剂过多;
E.容量瓶不干燥,不影响溶液的浓度;
F.定容时,仰视容量瓶刻度线,读得的溶液的体积增大;
(4)配制500 mlL 0.1molL-1溶液需要的固体Na2CO3的质量为0.1mol/L×0.5L×106g/mol=5.3g,加入少量水溶解后,冷却至室温,沿玻璃棒将溶液引流入500mL的容量瓶中,洗涤烧杯和玻璃棒2-3次,将洗涤液也注入容量瓶中,摇匀后项容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水至凹液面最低点与刻度线相切,摇匀,溶液配制完成,据此分析配制过程的正确与否。
(1)根据标签中的数据可知,浓硫酸的浓度c=![]() =
=![]() =18.4mol/L,欲配制1mol/L的稀硫酸220mL,需要用容量瓶配制250mL溶液,利用稀释定律可得出需要浓硫酸的体积V(浓)=
=18.4mol/L,欲配制1mol/L的稀硫酸220mL,需要用容量瓶配制250mL溶液,利用稀释定律可得出需要浓硫酸的体积V(浓)=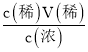 =
=![]() =0.0136L=13.6mL;
=0.0136L=13.6mL;
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是250mL容量瓶和胶头滴管;
(3)A.用量筒量取浓硫酸时俯视,导致量取的浓硫酸的体积偏小,配制的溶液中溶质的物质的量偏小,因此溶液的浓度偏小,A项不符合题意;
B. 稀释浓硫酸时,未冷却到室温即转移到容量瓶中,冷却后溶液的体积缩小,导致溶液的浓度偏高,B项符合题意;
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,溶质的物质的量增大,导致溶液的浓度偏高,C项符合题意;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,加入的溶剂过多,导致溶液的浓度偏低,D项不符合题意;
E.容量瓶不干燥,不影响溶液的浓度,E项不符合题意;
F.定容时,仰视容量瓶刻度线,读得的溶液的体积增大,导致溶液的浓度偏低,F项不符合题意;
溶液浓度偏高的是BC;
(4)溶解冷却后的碳酸钠溶液转移入容量瓶,再将洗涤液也转移入容量瓶中后,将溶液摇匀,图中没有摇匀的步骤;用胶头滴管滴加水时,视线要平视,因此错误的步骤有2处。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆