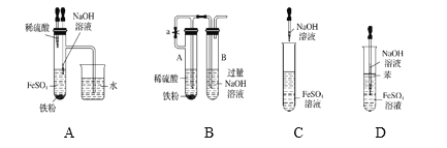
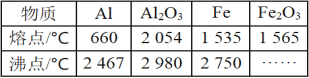
��Ŀ����
����Ŀ�����ݻ�Ϊ2L�ĸ����ܱ������м���1molCO2��3molH2��������Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)���������������������£��¶ȶԷ�Ӧ��Ӱ����ͼ��ʾ(ע��T1��T2������300��)������˵����ȷ���ǣ� ��
CH3OH(g)+H2O(g)���������������������£��¶ȶԷ�Ӧ��Ӱ����ͼ��ʾ(ע��T1��T2������300��)������˵����ȷ���ǣ� ��
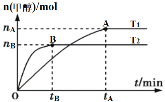
A.�÷�Ӧ��T1ʱ��ƽ�ⳣ������T2ʱ��С
B.����A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ![]() ��С
��С
C.T2ʱ����Ӧ�ﵽƽ��ʱ���ɼ״��ķ�Ӧ����v(CH3OH)=![]() mol��L-1��min-1
mol��L-1��min-1
D.T1ʱ������Ӧ�ﵽƽ���CO2��ת����Ϊx���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ(2-x)��2
���𰸡�D
��������
A��ͼ�������֪�ȹ���ƽ�¶ȸߣ�T1��T2���¶�Խ��ƽ��ʱ���ɼ״����ʵ���ԽС��˵������ӦΪ���ȷ�Ӧ�����¶�Խ�ߣ�ƽ�ⳣ��ԽС���÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ�A����
B��������֪T1��T2��A�㷴Ӧ��ϵ��T1�䵽T2������ƽ��������У��ﵽƽ��ʱ![]() ����B����
����B����
C��T2�´ﵽƽ��״̬�״����ʵ���nB����Ӧ�ﵽƽ��ʱ���ɼ״���ƽ������Ϊv��CH3OH����![]() molL��1min��1����C����
molL��1min��1����C����
D��T1�£�����Ӧ�ﵽƽ���CO2ת����Ϊx����
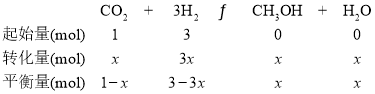
�������ڵ�ѹǿ����ʼѹǿ֮�ȣ�![]() ����D��ȷ����ѡD��
����D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ